
EVALUACIÓN DE LA QUÍMICA DE LOS NUTRIENTES Y DEL RIESGO DE EUTROFIZACIÓN EN CUENCA DEL RÍO MANZANARES, VENEZUELA
Evaluation of nutrient chemistry and eutrophication risk in the Manzanares river basin, Venezuela
RESUMEN
El objetivo de esta investigación fue evaluar la variación de la concentración, carga másica y determinar, los factores que controlan su química de los nutrientes; y comprobar mediante proporciones molares de nutrientes, y de valores indicadores potenciales de eutrofización costera (ICEP), la existencia de riesgo de eutrofización asociado con el flujo de nutrientes desde la cuenca alta del río Manzanares hacia las aguas costeras receptoras. Los resultados indicaron que todos los compuestos de nitrógeno y fósforo presentan variaciones significativas en los meses estudiados, mientras que por sub-cuencas solo se apreciaron en el amonio, nitrito y fosfato, siendo la concentración de nitrato el componente principal de la carga de nitrógeno inorgánico disuelto (NID). Las cargas másicas (ton/día) medias aumentaron desde la cuenca alta hasta la baja, siendo los valores de las tres sub-cuencas (alta, media y baja) fueron de 0,011; 0,055; 0,088 NH4+, 0,075; 0,43; 0,36 NO3-+NO2; 0,14; 0,58; 0,88 NT; 0,019; 0,073; 0,17 PO43-; 0,025; 0,11; 0,19 PT; 0,23; 3,68; 16,16 Si(OH)4, respectivamente, y los aportes medios a la zona costera de 0,24 NH4+; 1,61 NO3-+NO2; 2,24 NT; 0,46 PO43-; 0,54 PT, y 24,16 Si (OH)4. Los valores positivos de N-ICEP y P-ICEP (4,60 y 11,76) en el período de lluvia, revelaron un exceso de nitrógeno sobre el transporte de sílice, lo cual puede crear un problema de eutrofización y floración de algas nocivas (FAN) en las aguas costeras receptoras. Los resultados indican que se requieren medidas de remediación para reducir la carga de nitrógeno procedente de las diferentes fuentes.
Palabras clave: nutrientes, variación, eutrofización, ICEP, río Manzanares.
ABSTRACT
The objective of the present investigation was to evaluate the variation in concentration, mass load and determine the factors that control its nutrient chemistry; and verify, through molar proportions of nutrients, and potential coastal eutrophication indicator values (ICEP), the existence of eutrophication risk associated with the flow of nutrients from the Manzanares River basin to the receiving coastal waters. The results indicated that all nitrogen and phosphorus compounds present significant variations in the months studied, while by sub-basins they were only observed in ammonium, nitrite and phosphate, with nitrate concentration being the main component of the inorganic nitrogen load. dissolved (NID). The average mass loads (ton/day) increased from the upper basin to the lower one, with the values of the three sub-basins (high, medium and low) being 0.011; 0.055; 0.088 NH4+, 0.075; 0.43; 0.36 NO3-+NO2; 0.14; 0.58; NT 0.88; 0.019; 0.073; 0.17 PO43-; 0.025; 0.11; 0.19 PT; 0.23; 3.68; 16.16 Si(OH)4, respectively, and the average contributions to the coastal zone of 0.24 NH4+; 1.61 NO3-+NO2; 2.24 NT; 0,46 PO43-; 0.46 0.54 PT, and 24.16 Si(OH)4. The positive values of N-ICEP and P-ICEP (4.60 and 11.76) in the rainy period revealed an excess of nitrogen over silica transport, which can create a problem of eutrophication and harmful algal blooms (HABs) in receiving coastal waters. The results indicate that remediation measures are required to reduce the nitrogen load from the different sources.
Keywords: nutrients, variation, eutrophication, ICEP, Manzanares river.
INTRODUCCIÓN
El régimen de nutrientes en los ecosistemas de agua dulce es uno de los factores más importantes que regulan la diversidad biológica y la productividad de los ecosistemas lóticos y lénticos (Dai et al., 2022); por otra parte, las concentraciones relativas de nitrógeno y fósforo y sus proporciones pueden funcionar como índices importantes que reflejan las limitaciones de nutrientes de los productores primarios en los ecosistemas acuáticos, y la productividad general de los ecosistemas de agua dulce (Tokareva y Prokushkin, 2022). La escorrentía de las áreas de cuencas hidrográficas que tienen diferentes tipos de uso de la tierra, es recibida por los ríos, los cuales actúan como conductos que transportan nutrientes en forma disuelta y suspendida desde la tierra hasta un cuerpo de agua receptor, que puede ser un río, un lago o un océano (Adamczuk et al., 2019; Tivig et al., 2024); es por eso, que la exportación de nutrientes fluviales es un proceso importante en la biogeoquímica costera marina, que afecta también a la biología marina global (Tokareva y Prokushkin, 2022). Los nutrientes en un sistema acuático pueden provenir de aportes alóctonos (materiales meteorizados de su llanura de inundación, precipitación atmosférica, aguas residuales domésticas y escorrentía de las áreas agrícolas) y de aportes autóctonos, como producción de materia orgánica y su mineralización en el curso del río (Adamczuk et al. 2019; Ravi et al. 2021).
En las últimas décadas, el incremento en las concentraciones y cargas másicas de nutrientes, especialmente N y P han aumentado en casi todos los cuerpos de agua del mundo, y han tenido efectos tanto positivos como negativos (Ravi et al., 2021; Beusen y Bouwma, 2022; Ke et al., 2023). En lo positivo, el uso creciente de fertilizantes ha permitido a los agricultores producir volúmenes cada vez mayores de alimentos para la población humana en rápido crecimiento. En lo negativo, la producción agrícola y los vertidos de aguas residuales, han alterado en gran medida la cantidad y distribución de nutrientes en las biosferas terrestres y acuáticas y han alterado la estructura y el funcionamiento de los ecosistemas acelerando los ciclos globales de nutrientes (Beusen et al., 2022). Por ejemplo, las actividades antropogénicas han duplicado aproximadamente la cantidad de nitrógeno reactivo (N) que ingresa a la biosfera terrestre (Galloway et al., 2008) y han redistribuido el fósforo (P) en todo el mundo debido a la minería y el uso de fertilizantes (Gilbert, 2019). Por otra parte, la distribución y la cantidad de N y P en el medio ambiente ha provocado una amplia gama de impactos ambientales negativos; estos incluyen aumento de la turbidez del agua y degradación de los suministros de agua potable con crecientes preocupaciones por la salud humana (Ward et al., 2018; Pennino et al., 2020; Yu et al., 2024), contaminación de las aguas subterráneas, agotamiento del oxígeno, mayor eutrofización, y floraciones de algas nocivas (FAN), pérdida de hábitat bentónico y de biodiversidad, y contribuciones al cambio climático (Rabalais, 2002; Thompson et al., 2019; Fagodiya et al., 2017; Tesoriero et al., 2024). Dentro de todos estos efectos, la eutrofización y la pérdida asociada de servicios ecosistémicos se encuentran ahora entre los problemas ambientales globales más graves considerados por la ONU (Beusen et al., 2022).
En la actualidad hay un consenso científico, que además de la carga de nutrientes en sí, el estudio de la relación estequiométrica de nutrientes es esencial, ya que la alteración de la relación N:P, más allá de la relación molar de Redfield de 16:1 (Redfield, 1963), es una de las principales causas de la proliferación de floraciones de algas nocivas (FAN) incluso en una situación de disminución de las cargas de nutrientes (Glibert, 2019; Beusen et al., 2022). Un método útil para estudiar la exportación de nutrientes fluviales de nitrógeno, fósforo y sílice hacia la zona costera es el Indicador de potencial de eutrofización costera (ICEP; por sus siglas en inglés). Los valores de ICEP se utilizan para evaluar la alteración relativa en la relación de nutrientes disueltos (la relación C: N: P: Si de 106:16:1:15 es requerida para la productividad primaria) y la producción de fitoplancton no silíceo en el cuerpo de agua receptor (Redfield et al. 1963; Gilles y Garnier, 2007; Garnier et al., 2010, Ravi et al., 2021), y que permite determinar los posibles problemas resultantes de una nueva producción de algas no silíceas, sustentada por aportes externos de N y/o P y deficiencia de sílice, es decir, en condiciones limitantes para el crecimiento de las diatomeas. En comparación con las relaciones N: P que se consideran a menudo, el ICEP agrega información sobre el papel del silicio (Si) en la determinación de los posibles impactos de eutrofización, y de los cambios en la estequiometría de los elementos. (Garnier et al. 2010; Beusen y Bouwma, 2022, Beusen et al., 2022).
El río Manzanares en Venezuela, ofrece servicios ecosistémicos variados, incluyendo el agua potable y de regadío, la pesca de subsistencia que practica gran parte de los pobladores ribereños, e incluso las actividades de índole turística en el cauce principal y sus tributarios (Márquez et al., 2000; Márquez et al., 2002; Salazar et al., 2018; Márquez et al., 2019). Actualmente, el río Manzanares tiene un cauce colmatado de sedimentos y un caudal empobrecido y contaminado producto de una problemática ambiental compleja que se desarrolla a largo de toda la cuenca (Castro-Moreno et al., 2017; Márquez et al., 2019). Según Salazar et al. (2018) y Márquez et al. (2019), las aguas de la cuenca alta y media están impactadas por los desechos generados por las actividades agrícolas intensivas y extensivas que, aunadas a las descargas de aguas servidas domésticas sin tratamiento, introducen al cuerpo de agua sustancias potencialmente contaminantes. Además, la cuenca media recibe los desechos químicos del central azucarero de Cumanacoa y en la cuenca baja gran parte de los desechos urbanos llegan al río a través de los canales de desagüe; estos fueron construidos para darle salida a las aguas de lluvia, pero la urbanización de sus riberas lo han convertido en una fuente de contaminación, ya que son utilizados para la descarga de aguas servidas de poblaciones que carecen de redes cloacales y también para el vertido de desechos sólidos (Márquez et al., 2019).
Las procesadoras de pescado, según Senior y Godoy (1991) y Martínez y Senior (2001), vierten al río el agua salada y los desechos orgánicos, sólidos y líquidos, producto del lavado del pescado y de las máquinas operadoras. En relación a la presencia de nutrientes (P y N), el transporte medio de nutrientes aumenta hacia las cuencas media y baja, debido principalmente a que estas zonas presentan los mayores caudales y se encuentran impactadas por la acción antropogénica (Medina et al., 2013). En vista de que el aumento de las fuentes de nutrientes fluviales ha afectado significativamente el entorno ecológico de los estuarios y las aguas costeras a nivel mundial y ha provocado un deterioro de la calidad de las aguas terrestres, marinas y una intensificación de la eutrofización, y de que en la cuenca del río Manzanares los estudios relacionados a nutrientes son escasos.
El objetivo del presente estudio fue: (1) evaluar la variación de la concentración y carga másica de nutrientes; (2) determinar los factores que controlan la química de nutrientes en la cuenca del río Manzanares; (3) comprobar el potencial del río Manzanares para causar eutrofización en la zona marino costera mediante el uso de índices de elementos disueltos e indicadores para valores de potencial de eutrofización costera (ICEP). La aplicación de ICEP es el primer estudio realizado en Venezuela, y es de importancia ya que el río Manzanares desemboca en el golfo de Cariaco, el cual posee un gran potencial ecológico y es una de las áreas de alta productividad del Mar Caribe, ya que representa uno de los 5 sectores que conforman el área total de distribución y de pesca en el nororiente de Venezuela.
MATERIALES Y MÉTODOS
Área de estudio
La cuenca del río Manzanares (Figura 1) se ubica en el extremo nororiental costero de Venezuela (Estado Sucre). El río Manzanares nace en el macizo del Turimiquire a una altura alrededor de los 2.300 msnm (cerro Las Peonías). El cauce tiene una longitud de 81 km, posee una pendiente mínima de 15 % y un gasto medio de 1,23 m3 s-1. La cuenca tiene alrededor de 1 652 km2, con una descarga estimada en 6 108 m3 año-1, la cual se ha ido incrementado (más del 20 %) a 771 106 m3 año-1 (Márquez et al., 2000; Márquez et al. 2002; Márquez et al. 2019). El cauce principal del río Manzanares recibe cerca de diez ríos, 13 riachuelos y quebradas por su margen derecho y 14 ríos principales y seis secundarios por el margen izquierdo (Márquez et al., 2000; Ruíz et al., 2005). En el año 1970 se construyó un canal de Aliviadero (marcado con la letra H en el mapa), en el sector Puerto de la Madera para prevenir las inundaciones en el centro de la ciudad de Cumaná, debido a la crecida del río durante el período de lluvia. En la región el período de sequía comienza a partir del mes de diciembre, cuando la zona de convergencia intertropical (ZCIT) se encuentra más cerca del Ecuador y el de sequía finaliza en junio, cuando se inicia la migración hacia el norte de la ZCIT. El período de lluvia inicia en el mes de julio y finaliza en noviembre, teniendo sus máximos valores en el bimestre agosto-septiembre (Salazar et al., 2018; Márquez et al., 2019).
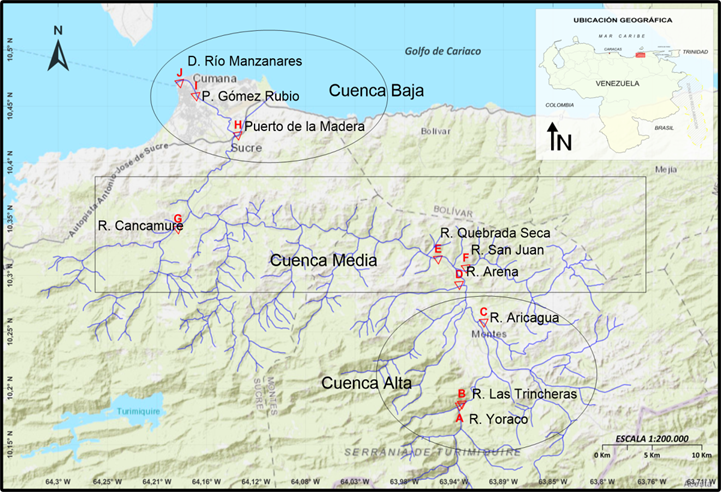
Figura 1. Área de estudio mostrando los sitios de muestreos en la cuenca del río Manzanares
Diseño del muestreo
Con las diferencias del gradiente altitudinal y tomando la descripción por tramos de Márquez et al. (2019), por fines prácticos, la cuenca del Manzanares fue dividida en tres secciones o sub-cuencas, cuenca alta (entre los ríos Yoraco y Aricagua), media (entre los ríos Arenas y Cancamure) y baja (Puerto la Madera Aliviadero hasta la desembocadura del Manzanares en el golfo de Cariaco). Se realizaron dos muestreos de diez estaciones cada uno, el 26 de septiembre del año 2017 (mes de lluvia) y el 3 de abril del 2018 (mes de sequía), en el canal principal del Manzanares y varios de sus tributarios, (río Yoraco (A), Las Trincheras (B), río Aricagua (C), río Arenas (D), Quebrada Seca (E), río San Juan (F), río Cancamure (G), Puerto de la Madera del Manzanares (H), Puente Gómez Rubio (I), desembocadura del río Manzanares (J) (Figura 1). Las estaciones de muestreo fueron geo-referenciadas con un GPS Garmin 12xl.
Medición de los caudales
Matemáticamente se representa como la velocidad del agua (m s-1) multiplicado por el área de la sección (m2), lo que produce un volumen (m3 s-1). A partir de este factor, y tomando en cuenta la concentración de los elementos en el sistema, se puede estimar la masa de metales que está siendo aportada a una zona específica. El caudal (m3 s-1) se calculó utilizando Ec.1

Dónde:
Q = Caudal o gasto (m3 s-1)
A = Área de la sección transversal (m2)
V = Velocidad media del agua en el punto (m s-1)
El caudal se determinó mediante un flujómetro, siguiendo los principios del método del molinete (Chow, 1994). El molinete es un instrumento que tiene una hélice o rueda de cazoletas, que gira al introducirla en una corriente de agua. El de tipo de taza cónica gira sobre un eje vertical y el de tipo hélice gira sobre un eje horizontal. En ambos casos la velocidad de rotación es proporcional a la velocidad de la corriente; se cuenta el número de revoluciones en un tiempo dado. Se utilizó un flujómetro TSK de 7,5 de longitud y 8,5 cm de diámetro de flujo mínimo de 8 cm s-1 y máximo de 3 m s-1, en vez de un molinete, pero el principio es el mismo. El rango de calibración fue de 0, 25- 2,33 m s-1. La sección elegida para la medida con el molinete se situó en un tramo recto en la sección más homogénea posible del río y se realizaron varias mediciones, puesto que el molinete mide la velocidad en un único punto. Se tomaron medidas del ancho del río y se realizaron tres mediciones, dos en cada extremo y uno en el centro del río. La profundidad de cada sitio también fue medida. Los caudales finales fueron reportados y reportados en m3 s-1
Recolección y análisis de las muestras
La recolección, conservación y transporte de las muestras al laboratorio se llevaron a cabo según el protocolo establecido en APHA (1995). Con un recipiente plástico de 10 L (diez litros) se recolectaron muestras de agua superficial y se colocaron en envases de 1 L de capacidad previamente rotulados y lavados con una solución ácida (HCl 1 mol L-1) y agua desionizada, calidad Nanopure de conductividad de 18 MΩ cm-1. Las muestras se transportaron luego en una hielera al laboratorio, excepto la muestra recolectada para el análisis de DBO5, ya que esta requiere ser incubado a una temperatura más alta, y luego se preservaron bajo congelación a -20 ºC hasta su procesamiento.
La temperatura, conductividad y pH se midieron in situ utilizando una sonda multiparamétrica Waterproof Tester EZDO modelo 7200 con una precisión de ± 0,10 ºC; 1µS cm-3 y ± 0,010 unidades respectivamente. Las concentraciones de oxígeno disuelto son determinadas por el Método de Winkler, la precisión del método es de ± 0,03 mL L-1 (Aminot y Chaussepied, 1983). La concentración de demanda bioquímica de oxígeno (DBO5) se determinó por el método de Winkler (APHA, 1995), mediante un cambio en las concentraciones de oxígeno disuelto durante un período de incubación de las muestras de agua en botellas de vidrio durante 5 días a 20 oC. La precisión es de ± 0,043 mg L-1. La saturación de oxígeno disuelto (% O2sat) se obtuvo mediante una ecuación empírica (Weiss, 1970). Los sólidos totales, suspendidos y disueltos se determinaron por gravimetría (APHA, 1995). La técnica cubre un rango de 10 hasta 20.000 mg L-1 para sólidos totales, de 4 hasta 20.000 mg L-1 para los suspendidos y de 10 hasta 20.000 mg L-1 para los disueltos.
La determinación de los nutrientes se hizo de manera automatizada, utilizando un autoanalizador Technicon II AC-100 (Scientific Instruments). La determinación de nitritos, se realizó por el método de Bendschneider y Robinson (1952) y detallado por Strickland y Parsons (1972). Los iones nitrito presentes forman un diazoico con la sulfanilamida en medio ácido (pH<2). Luego el compuesto diazoico reacciona con N-naftil-etilendiamina para formar un colorante rosado, el cual tiene un máximo de absorción a 543 nm. La concentración del nitrato se determinó según el método de Treguer y Le Corre (1975), y optimizado en Strickland y Parsons (1972). La técnica mide la suma de las concentraciones de los iones NO2- y NO3-. Por sustracción de la concentración de nitrito se obtiene la concentración de nitrato. La reducción de los iones nitrato a nitrito se efectúa por el paso de la muestra a través de una columna que contiene cadmio granulado tratado con cobre. La determinación del amonio, se hizo por el método de Koroleff (1976). El método mide la totalidad del nitrógeno amoniacal N-NH3 + N-NH4. En un frasco de vidrio de 150 mL y con tapas de poliestireno, se colectaron 100 mL de muestra. La misma se fijó in situ con 3 mL de una solución alcalina de hipoclorito de calcio en citrato e hidróxido de sodio, y 3 mL de una solución de fenol-nitroprusianato. El amoniaco forma una monocloroamina con el hipoclorito de sodio en medio ligeramente básico. La monocloroamina formada reacciona con una cantidad de fenol que fue añadida en forma de solución fenol- nitroprusianato de sodio (Na2 Fe (CN)5 NO.2H2O) en presencia del hipoclorito que forma un azul de indofenol. La reacción es acelerada con el nitroprusianato. La longitud de onda utilizada en las mediciones por este método es de 640 nm. El nitrógeno inorgánico total (NI) fue calculado mediante la sumatoria de las concentraciones de nitratos, nitritos y amonio. Los límites de detección analíticos para la determinación diferentes formas del nitrógeno son amonio 0,10 μmol L-1, nitrito 0,01 μmol L-1, nitrato 0,04 μmol L-1.
La concentración de fósforo inorgánico reactivo o fosfato (PI), se determinó por el método colorimétrico de Murphy y Riley (1962). Los iones fosfato reaccionan con el molibdato de amonio, en presencia de antimonio (III), para formar un complejo que es reducido posteriormente por el ácido ascórbico y esta forma reducida de fósforo es azul, con un máximo de absorción a 885 nm. El límite de detección para fosfato es 0,02 μmol L-1. Las concentraciones de nitrógeno total (NT) y fósforo total (PT) se analizaron por digestión simultánea (Valderrama, 1981), que consiste en la oxidación simultánea del nitrógeno y el fósforo total con una solución de persulfato de potasio. Para la oxidación de los compuestos nitrogenados se utilizó un medio alcalino, mientras que la oxidación de los compuestos de fósforo se realizó en medio ácido. Para el nitrógeno total, la precisión oscila alrededor de 4 % y la del fósforo alcanza 0,2 %. La concentración de silicatos se cuantificó por el método de Treguer y Le Corre (1975), con los fundamentos de Mullin y Riley (1955) y la optimización de Strickland y Parsons (1972); que se basa en la formación de un complejo silicomolibdico que al ser reducido con una solución de metolsulfito, ácido oxálico y ácido sulfúrico, da un color azul intenso, con un máximo de absorción de 810 nm. El límite de detección para silicato es 0,40 μmol L-1.
Determinación de las cargas másicas
La carga másica (ton día-1) de sólidos y metales pesados de toda la cuenca se estimó multiplicando la concentración de cada elemento de interés, por el caudal medido en ese mismo sitio. Esto se realizó para cada uno de los dos meses muestreados, y fueron calculadas utilizando Ec. 2.

Dónde:
C = carga másica (ton/día)
Q = caudal
Ci = concentración del elemento
Descarga de nutrientes al golfo de Cariaco
El golfo de Cariaco recibe la descarga de sólidos y nutrientes provenientes de las aguas que pasan por la estación Puerto de la Madera (estación 8) que corresponde a un aliviadero construido en el año 1970 para evitar las inundaciones en el centro de la ciudad de Cumaná, y las que llegan a desembocadura del río Manzanares (estación 10). Para estimar la magnitud de estas descargas, se sumaron las cargas másicas de los sólidos y de metales pesados en esas dos estaciones, durante los meses de septiembre de 2017 y abril de 2018. La descarga se calculó utilizando Ec.3.
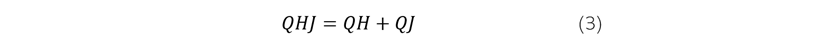
Donde:
QH= descarga del elemento en la estación Puerto de la Madera
QJ = descarga del elemento en la estación desembocadura del Manzanares
QHJ = descarga total del elemento al golfo de Cariaco.
Indicador de potencial de eutrofización costera (ICEP)
Se calculó utilizando (Ec 4 y Ec 5)
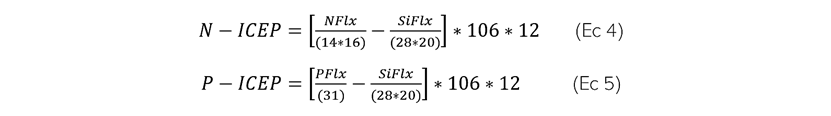
Donde, PFlx, NFlx y SiFlx son los flujos específicos medios de nitrógeno total, fósforo total y sílice disuelta, respectivamente, entregados a la salida de la cuenca fluvial (desembocadura del río Manzanares), expresados en kg P km-2 día-1, kg N km-2 día-1 y kg Si km-2 día-1. Para el cálculo de los flujos específicos se consideró la concentración de los nutrientes, el caudal y el área de drenaje de la cuenca del río Manzanares (1.652 km). Los criterios para interpretar el ICEP es que un valor negativo del ICEP indica que la sílice está presente en exceso con respecto a los otros nutrientes y, por lo tanto, caracterizaría la ausencia de problemas de eutrofización. Los valores positivos indican un exceso de N o P con respecto a los requisitos para el crecimiento de diatomeas, por lo tanto, una condición para el desarrollo de algas no silíceas potencialmente dañinas. El ICEP representa el impacto potencial del suministro fluvial a la zona costera y no tiene en cuenta las condiciones morfológicas, climáticas e hidrológicas particulares que determinan localmente la respuesta de las algas marinas en la zona costera receptora (Gillen y Garnier, 2007; Garnier et al., 2010).
Análisis estadístico
El análisis estadístico, incluido el análisis de componentes principales y el coeficiente de correlación de Spearman, se utilizó para delinear los factores que controlan la química de la cuenca del río Manzanares. Se realizó una comprobación de la normalidad de los datos, mediante el test de Shapiro-Wilk y Anderson-Darlin. El test indicó que los datos no son paramétricos, luego se procedió a determinar las posibles variaciones estadísticas en los caudales, concentraciones de los nutrientes y parámetros fisicoquímicos durante los dos meses de muestreo (septiembre 2017 y abril 2018) y en las tres sub-cuencas del río Manzanares (alta, media y baja). Para este propósito las muestras fueron agrupadas en factores, los cuales se identificaron en el análisis como muestreos (septiembre 2017 y abril 2018), y sub-cuencas: cuenca alta (río Yoraco, Las Trincheras, y río Aricagua), media (río Arenas, Quebrada Seca; río San Juan; río Cancamure; baja (Puerto de la Madera; Puente Gómez Rubio, desembocadura del río Manzanares). Por no cumplirse los supuestos de normalidad, homocedasticidad fue empleado el análisis de Kruskal-Wallis (K.Wallis). La asociación entre los distintos parámetros se realizó a través del Análisis de Componentes Principales (ACP) y se aplicó análisis de correlación de Spearman a un nivel de significancia P<0,05 (Johnson y Wichern, 1992). Todos los análisis estadísticos fueron realizados utilizando los paquetes Statgraphics Centurión 16.103y XLStat-Pro v 7.5.2 acoplado al Microsoft Excel 2010.
RESULTADOS Y DISCUSIÓN
Variación de los parámetros fisicoquímicos, concentración y cargas másicas de nutrientes disueltos y totales
Los parámetros fisicoquímicos en la cuenca del río Manzanares mostraron variaciones significativas en los meses muestreados solo para caudal, oxígeno disuelto, DBO5, sólidos suspendidos, y compuestos de nitrógeno y fósforo, mientras que por sub-cuencas solo se apreciaron para el caudal, temperatura, pH, sólidos disueltos, amonio, nitrito y fosfato (Tabla 1). El valor de los caudales se incrementó desde la cuenca alta hacia la media y baja. El caudal promedio para septiembre del 2017 fue de 44,9 m3 s-1, variando entre un mínimo de 4,57 m3 s-1 en la estación río Yoraco (cuenca alta) y un máximo de 159,5 m3 s-1 en la estación desembocadura del río Manzanares (cuenca baja). En abril del 2018, el caudal promedio se redujo a 7,93 m3 s-1, con un mínimo de 0,15 m3 s-1 en el río Yoraco y un valor máximo de 22 m3 año-1, en la estación Quebrada Seca, cuenca media (Figura 2A). Los promedios para cada sub-cuenca en septiembre del 2017 fueron de 96, 49 m3 s-1, 31,75 ym3 s-1 y 10,70 m3 s-1 respectivamente, y para abril del 2018 fueron 10,35; 11,02 y 1,38 para las cuencas alta y media (Figura 3A).
Tabla 1. Estadísticos derivados del test de Kruskal-Wallis (P<0,05) para las variables fisicoquímicas y metales pesados en las aguas de la cuenca del río Manzanares.
|
Parámetro |
Factor |
P |
K.W |
G.S |
Parámetro |
Factor |
P |
K.W |
G.S |
|
|
Meses |
0,01 |
6,61 |
S |
SD (mg L-1) |
Meses |
0,61 |
1,20 |
NS |
|
|
Sub-cuenca |
0,08 |
5,11 |
S |
Sub-cuenca |
0,02 |
7,49 |
S |
|||
|
t (°C) |
Meses |
0,91 |
0,01 |
NS |
NH4+ (mg L-1) |
Meses |
0,00 |
14,32 |
S |
|
|
Sub-cuenca |
0,00 |
13,42 |
S |
Sub-cuenca |
0,00 |
0,35 |
S |
|||
|
C.E (mS cm-3) |
Meses |
0,33 |
0,97 |
NS |
NO2-(mg L-1) |
Meses |
0,00 |
14,32 |
S |
|
|
Sub-cuenca |
0,06 |
0,97 |
NS |
Sub-cuenca |
0,03 |
6,73 |
S |
|||
|
pH |
Meses |
0,31 |
1,04 |
NS |
NO3- (mg L-1) |
Meses |
0,00 |
10,09 |
S |
|
|
Sub-cuenca |
0,00 |
12,76 |
S |
Sub-cuenca |
0,80 |
0,45 |
NS |
|||
|
O2 (mg L-1) |
Meses |
0,00 |
14,31 |
S |
NT (mg L-1) |
Meses |
0,00 |
14,29 |
S |
|
|
Sub-cuenca |
0,92 |
0,18 |
NS |
Sub-cuenca |
0,77 |
0,53 |
NS |
|||
|
DBO5 (mg L-1) |
Meses |
0,00 |
12,63 |
S |
PO43-( mg L-1) |
Meses |
0,03 |
4,82 |
S |
|
|
Sub-cuenca |
0,43 |
1,70 |
NS |
Sub-cuenca |
0,03 |
0,80 |
S |
|||
|
ST (mg L-1) |
Meses |
0,79 |
0,07 |
NS |
PT (mg L-1) |
Meses |
0,88 |
0,02 |
S |
|
|
Sub-cuenca |
0,05 |
6,14 |
NS |
Sub-cuenca |
0,13 |
4,01 |
NS |
|||
|
SS (mg L-1) |
Meses |
0,00 |
9,39 |
S |
Si(OH)4(mg L-1) |
Meses |
0,91 |
4,01 |
NS |
|
|
Sub-cuenca |
0,61 |
9,39 |
NS |
Sub-cuenca |
0,37 |
2,00 |
NS |
P=Valor de significancia; K.W= Estadístico de Kruskal-Wallis; G.S. Grado se significancia; S=significativo; NS=no significativo
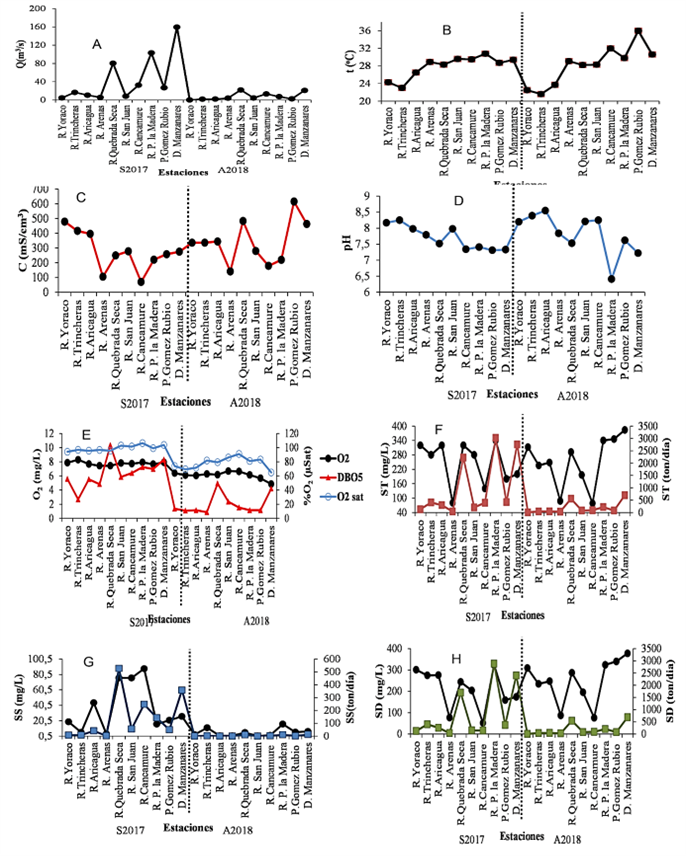
Figura 2. Variación espacio-temporal del caudal (2A), temperatura (2B), conductividad eléctrica (2C), pH (2D), oxígeno disuelto, DQO5 y oxígeno de saturación (2E), en la cuenca del río Manzanares durante septiembre 2017 (S2017) y abril 2018 (A2018).

Figura 3. Valor promedio del caudal (3A), temperatura (3B), conductividad eléctrica (3C) oxígeno disuelto, DBO5 y pH (3D), oxígeno de saturación (3E), nutrientes nitrogenados, fosforados y de silicio disuelto (2F) y nitrógeno y fosforo total (2G) y solidos totales, suspendidos y disueltos (3H), en la cuenca alta, media y baja del río Manzanares (S2017=septiembre 2017; A2018=abril 2018).
La temperatura (t) en el muestreo de septiembre de 2017 presentó un promedio de 27,9 °C en toda la cuenca. El valor mínimo de temperatura se detectó en la estación Las Trincheras, en la cuenca alta, con 23 °C y el máximo de 30,8 °C, en la estación Puerto de la Madera, cuenca baja. Para el muestreo de abril del 2018 el promedio fue de 28 ºC, con un mínimo de 21,6 ºC en la estación. Las Trincheras, cuenca alta; y un máximo de 36 ºC en la estación Puente Gómez Rubio, cuenca baja (Figura 2B). Los promedios para las sub-cuencas fueron 24,60 ºC, 29,08 ºC y 29,63 ºC para 2017 y 22,60 ºC, 29,40 ºC y 32,13 °C para las cuencas alta, media y baja respectivamente (Figura 3B).
Para septiembre del 2017 se apreció un promedio en la conductividad eléctrica de 274,8 mS cm-3. El mínimo se registró en la estación río Cancamure, cuenca media, con un valor de 70 mS cm-3; y el máximo en la estación río Yoraco, cuenca alta, con 479 mS cm-3. Para el mes de abril del 2018, el promedio fue de 339,7 mS cm-3. El mínimo se observó en la estación río Arenas de la cuenca media, con un valor de 141 mS cm-3; y el máximo de 615 mS cm-3en estación Puente Gómez Rubio de la cuenca baja (Figura 2C). En las sub-cuencas las conductividades las conductividades decrecieron desde la cuenca alta hasta la media y luego se volvieron a incrementar hacia la cuenca baja. Los promedios fueron 430,33 mS cm-3, 175,75 mS cm-3, 251,33 mS cm-3durante septiembre del 2017 y para abril del 2018, 338,67 mS cm-3, 270 mS cm-3 y 432,67 mS cm-3para la cuenca alta, media y baja respectivamente (Figura 3C).
El comportamiento del pH en el río Manzanares para septiembre de 2017 mostró un promedio de 7,71. El valor mínimo fue de 7,31 y el valor máximo de 8,25, ambos registrados en las estaciones Gómez Rubio (cuenca baja) y Las Trincheras en la cuenca alta. Para el estudio de abril del 2018 el promedio fue de 7,82. El valor mínimo fue de 6,41, en la estación Puerto de la Madera, cuenca baja y el valor máximo de 8,55, en la estación el río Aricagua, cuenca alta (Figura 2D). El promedio para las sub-cuencas fue de 8,13; 7,66 y 7,35 para septiembre 2017 y 8,38; 796, y 7,08 para abril del 2018, para las cuencas altas, media y baja respectivamente (Figura 3D). El promedio de oxígeno disuelto para septiembre del 2017 fue de 7,78 mg L-1. El mínimo valor registrado fue de 7,44 mg L-1en la estación río Arenas, de la cuenca media; y el máximo de 8,3 mg L-1 en la estación Las Trincheras de la cuenca alta. En el muestreo de abril del 2018, el promedio fue de 6,18 mg L-1, con un mínimo de 4,85 mg L-1en la estación desembocadura del Manzanares, cuenca baja; y el máximo de 6,82 mg L-1en la estación Puerto de la Madera. Los promedios en las cuencas altas, media y baja fueron de 7,95, 761 y 7,83 mg L-1durante septiembre del 2017 y 6,18, 6,45 y 5,56 mg L-1 en abril del 2018 respectivamente (Figura 3D).
Los valores de oxígeno disuelto y pH en todas las estaciones se mantienen dentro de los valores de la normativa venezolana (Decreto 883), para las aguas de tipo II y tipo IV (aguas tratadas para consumo y uso recreacional) solo en la desembocadura los valores de oxígeno disuelto están por debajo de la normativa. Por otra parte, las concentraciones de DBO5 oscilaron entre 2,70 - 10,30 mg L-1 y promedio de 6,4 mg L-1 en septiembre del 2017. El valor mínimo se determinó en las Trincheras y el máximo en Quebrada Seca y la desembocadura del río Manzanares. Durante abril del 2018 los valores oscilaron entre 0,85 -4,93 mg L-1y promedio de 1,97 mg L-1. El mínimo se detectó en río Arenas y el máximo en Quebrada Seca y la desembocadura del río Manzanares (cuencas media y baja). El promedio para las cuencas altas, media y baja fue de 4,59, 6,86 y 7,52 mg L-1 en septiembre y 1,19, 2,41 y 2,16 mg L-1 en abril del 2018 respectivamente (Figura 3D). La DBO5 representa el oxígeno consumido por los microorganismos para degradar la materia orgánica presente en el sistema acuático y puede ser utilizado como proxy de la carga orgánica en el río (Hem, 1970, Ravi et al. 2021). Los máximos en la cuenca del Manzanares, estuvieron relacionados con las temperaturas más altas y los mayores caudales. Por otra parte, la concentración de oxígeno de saturación (O2sat) oscilaron entre 94-106 % y promedio de 99 % en septiembre del 2017 y entre 64-91 % con promedio de 78,22 % en abril del 2018. Durante abril se apreció instauración en toda la cuenca, reflejando procesos biológicos de consumo de oxígeno en las aguas (Figura 2E). Los promedios por subcuentas fueron de 95,56 %, 99,20 %, 103,14 % y 71,63 %, 84,54 % y 76,37 % para las cuencas altas, media y baja durante septiembre del 2017 y abril del 2018 respectivamente (Figura 3E).
Los sólidos totales para septiembre del 2017 a lo largo de toda la cuenca arrojaron un promedio de 246 mg L-1. El mínimo fue de 80 mg L-1 (estación río Arenas, cuenca media) y el máximo 340 mg L-1 (Puerto de la Madera, cuenca baja). Para abril de 2018, el promedio fue de 252 mg L-1. El mínimo fue de 78 mg L-1 en la estación río Cancamure, cuenca media; y el máximo de 384 mg L-1 en la estación desembocadura del Manzanares, cuenca baja (Figura 2F). Los sólidos suspendidos en el muestreo de septiembre de 2017 mostraron un promedio de 37 mg L-1. La concentración mínima y máxima fue en las estaciones río Arenas (3 mg L-1) y río Cancamure (88 mg L-1), respectivamente. El promedio general para abril 2018 fue de 5,02 mg L-1, el mínimo 0,60 de 3 mg L-1, en la estación río San Juan, cuenca media y el máximo de 16 mg L-1, en la Puerto de la Madera, cuenca baja (Figura 2G). Los sólidos disueltos para septiembre del 2017 arrojaron un promedio de 209 mg L-1; el mínimo (52 mg L-1) en la estación río Cancamure, cuenca media y el máximo (324 mg L-1), en Puerto de la Madera, cuenca baja. Para 2018 el promedio de toda la cuenca fue de 247,82 mg L-1; el mínimo en estación río Cancamure, cuenca media fue (76 mg L-1) y el máximo en la desembocadura del Manzanares (377,6 mg L-1), cuenca baja (Figura 2H). Los promedios para la cuenca alta media y baja fueron de 306,67; 205 y 240 mg L-1 en 2017 y 265,33; 163,50 y 356,67 mg L-1 de solidos totales en 2017 y 2018 respectivamente, y 22,69; 60,83 y 21 mg L-1 en 2017 y 4,80; 1,95; 9,33 mg L-1 en 2018 de solidos suspendidos y 283,97; 144,17; 219,00 mg L-1 y 263,67; 161,40; 347,20 mg L-1 de solidos disueltos en septiembre y abril del 2018 respectivamente (Figura 3F).
Las concentraciones de amonio oscilaron entre 0,008 - 0,030 mg L-1 (promedio 0,014) en septiembre de 2017 y entre 0,053 - 0,124 mg L-1 con promedio de 0,082 en abril. Los mínimos se determinaron en río Cancamure y río Arenas (cuenca media) y el máximo en río San Juan (cuenca media) y en el Puente Gómez Rubio (cuenca baja) en el 2017. En abril del 2018 el mínimo se observó en la desembocadura del río Manzanares (cuenca baja) y el máximo en Quebrada Seca y río San Juan (cuenca media) (Figura 4A). El promedio por sub-cuencas para la alta, media y baja fue de 0,017; 0,011; 0,016 mg L-1 en septiembre del 2017 y 0,093; 0,091 y 0,06 mg L-1 en abril del 2018 (Figura 3G).
Las concentraciones de nitrito más nitrato variaron entre 0,05 - 0,29 mg L-1 (promedio 0,15 mg L-1) en el 2017 y 0,18 - 0,57 mg L-1 (promedio 0,33 mg L-1) en 2018. Los valores de fosfato oscilaron entre 0,022 - 0,056 mg L-1 y promedio de 0,036 mg L-1 en 2017 y 0,0032 - 0,050 mg L-1 con promedio de 0,019 mg L-1 en 2018 (Figura 4B). El valor mínimo se detectó en río Arenas y en Puerto de la Madera y el máximo en río San Juan en septiembre 2017 (cuenca media); y en abril del 2018 el mínimo fue en el río Cancamure y el máximo en Quebrada Seca en la cuenca media (Figura 3G). Las concentraciones de nitrógeno total (NT) variaron entre 0,11 - 0,29 mg L-1 (promedio 0,20 mg L-1) durante el 2017 y 0,33 - 0,91 mg L-1 (media de 0,58 mg L-1) en abril del 2018. Las concentraciones mínimas se detectaron en 2017 y 2018 en río Arenas (cuenca media) y las máximas en Las Trincheras y en Río Yoraco (cuenca alta) (Figura 4C). Por sub-cuencas las concentraciones fueron 0,25; 0,20; 0,16 mg L-1 para la cuencas alta, media y baja en septiembre del 2017 y 0,61; 0,47 y 0,69 mg L-1 para abril del 2018 respectivamente (Figura.3H).
Las concentraciones de fósforo inorgánico disuelto (fosfato) (Figura 4D) variaron entre 0,022 - 0,056 mg L-1 con promedio de 0,036 y las de fosforo total entre 0,026 - 0,074 con promedio de 0,041 mg L-1 en septiembre de 2017; mientras que oscilaron entre 0,003 - 0,050 mg L-1 (media 0,019) para fosfato y 0,010 - 0,10 mg/L y promedio de 0,045 de fosforo total en abril del 2018 (Figura 4D y Figura 4E). Por sub-cuencas, las concentraciones promedio para fosfato fueron 0,049; 0,040; 0,036 mg L-1 en septiembre de 2017 y 0,050; 0,034; 0,055 mg L-1 en abril de 2018 en las cuencas alta, media y baja respectivamente. Para el fósforo total las concentraciones fueron 0,049; 0,040; 0,036 mg L-1 para septiembre del 2017 y 0,016; 0,034; 0,055 mg L-1 en abril de 2018 para las tres sub-cuencas (Figura 3H). Los porcentajes en los promedios de amonio respecto al nitrógeno total para septiembre 2017 y abril de 2018 fueron de 7 y 15 %; 5 y 19 %; 10 y 8 % para la cuenca alta y media respectivamente, y con respecto al nitrógeno total inorgánico disuelto 11 y 26 %; 5 y 22 %; 12 % para las tres sub-cuencas. Los de nitrito más nitrato con respecto al nitrógeno total fueron de 55 y 43 %; 92 y 66 %; 80 y 61 %; y con respecto al nitrógeno total inorgánico disuelto 89 y 74 %; 95 y 78 %; 88 y 87% respectivamente para las sub-cuencas alta, media y baja respectivamente. Por otra parte, los porcentajes de fosfato respecto al fósforo total fueron de 87 y 41 %; 84 y 52 %; 98 y 37 % para las sub-cuencas altas, media y baja.
Por otra parte, las concentraciones de silicatos fluctuaron entre 14 - 140 mg L-1 (media 103 mg L-1) en septiembre de 2017, el valor mínimo se detectó en río San Juan y el máximo en rio Arenas (cuenca media). En abril de 2018 la media fue de 103 mg L-1 (16 - 142 mg L-1); en Puente Gómez Rubio y desembocadura del río Manzanares (mínimos); rio Arenas y Quebrada Seca (máximos) (Figura 4F). Por sub-cuencas los valores promedio de silicatos fueron de 124,67; 101,75; 83 mg L-1 para septiembre de 2017 y 126; 102 y 80,67 mg L-1 para abril de 2018, para las cuencas alta, media y baja respectivamente (Figura 3G).
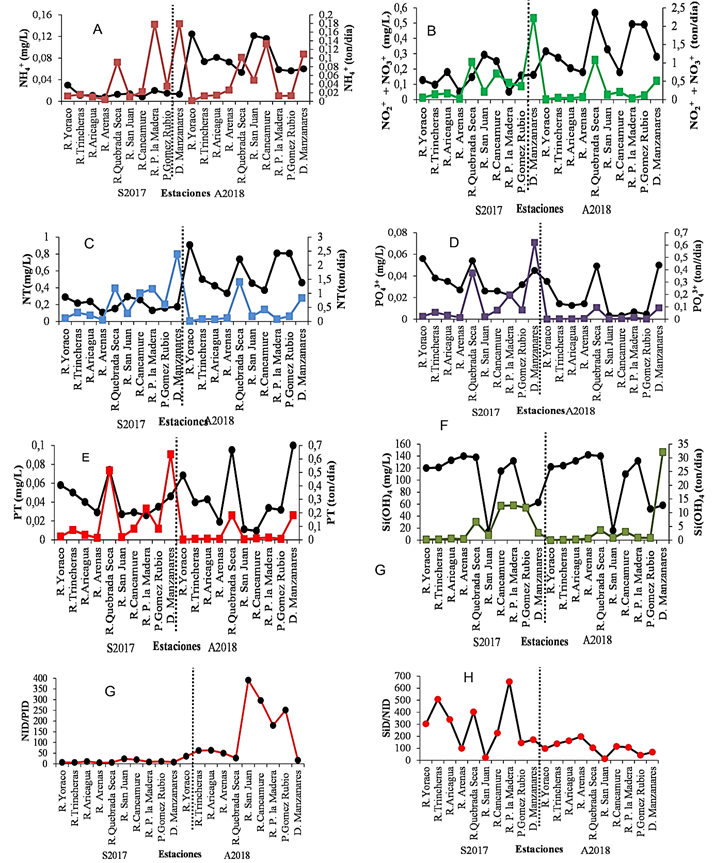
Figura 4. Variación de las concentraciones y cargas másicas de nutrientes en la cuenca del en la cuenca del río Manzanares durante septiembre 2017 y abril 2018. (A=amonio; B= nitrito+nitrato; C=nitrógeno total; D=fosfato; E=fósforo total; F=silicatos; G=relación NID/PID; H= SiD/NIP.
Las relaciones NID/PID variaron entre 5 - 23 y 17 - 391 (Figura4G) con un incremento hacia la cuenca baja especialmente en abril del 2018, indicativo de un aporte mayor de nitrógeno; por otra parte SiD/NIP osciló entre 23 - 654 y 13 - 198 (Figura 4H), esta última relación es mucho mayor que la relación 1:1 requerida para el óptimo crecimiento de diatomeas (Turner et al. 2003), que son componentes importantes de los ríos, ya que actúan como un importante transportador de nutrientes disueltos al océano y contribuyen con alrededor de 16,2; 2,6 y 194 Tg año-1 de nitrato, fosfato y silicatos respectivamente a los océanos (Turneret al., 2003; Ravi et al., 2021). Sin embargo, los descensos en las distribuciones desde la cuenca alta a la baja son reflejo del incremento de la carga de nitrógeno hacia la cuenca baja. En la desembocadura del Manzanares las relaciones NID/PID y SiD/NIP fueron de 8 y 17 NID/PID en septiembre del 2017 y abril del 2018 y 171 y 68 de SiD/NIP. La relación NID/PID en la mayor parte de la cuenca fue mayor que la de Redfiel 16:1 lo cual es indicativo de que hay limitación de fósforo. En la desembocadura, durante abril fue cercana a la de Redield 16:1, y en septiembre es menor, lo cual indica que el fósforo está en exceso durante ese mes. Relación DIN: DIP superior a 16:1 se ha informado en el 77 % de los ríos más grandes del mundo, lo que indica una mayor carga de nitrógeno debido a fuentes antropogénicas (Turner et al., 2003; Ravi et al., 2021). Las relaciones molares (N:Si:P) se han utilizado ampliamente para estimar la limitación de nutrientes de la productividad primaria en el ecosistema acuático. Si hay otros macro y micronutrientes presentes en cantidad suficiente, se requiere una relación N: Si: P de 16:15:1 para un crecimiento óptimo de fitoplancton y diatomeas (Redfield et al., 1963; Turner et al., 2003: Ravi et al. 2021).
Las variables fisicoquímicas en la cuenca del río Manzanares se asocian con los regímenes climáticos, geológicos y antrópicos de cada sub-cuenca. La geología en la cuenca alta contiene rocas metamórficas del Mesozoico, con unidades sedimentarias con diversos grados de metamorfismo y transformaciones de los materiales que dan lugar al desarrollo y evolución de los suelos, se equilibran en intensidad a las pérdidas por lavado y erosión, y ambos tipos de procesos son mayores a las ganancias de materiales; también los suelos son fértiles, con epipedón mólico, formación de estructura, redistribución de carbonatos y de aluminosilicatos (Elizalde et al., 1985). Los valores del caudal aumentan con las precipitaciones sobre la cuenca, es por esto que los máximos se midieron en septiembre del 2017. Esto se corrobora con el análisis de K.Wallis, el cual mostró diferencias estadísticamente significativas entre los dos meses de muestreo. Se observó un descenso en abril del 2018 en toda la cuenca de los promedios de caudal, conductividad, oxígeno disuelto, sólidos suspendidos, fosfatos, fósforo total, DBO5, respecto a septiembre de 2017.
La magnitud de los caudales de los ríos que integran la cuenca del río Manzanares juegan un papel importante, Márquez et al. (2002) reportaron registros históricos (1982-1990) de precipitación y caudales del río Manzanares, encontrando una relación lineal positiva entre el gasto mensual y las precipitaciones, indicando que el flujo de agua evoluciona paralelamente con las lluvias, siendo estas las que determinan la magnitud del caudal del río; alterando los valores y las concentraciones de los parámetros fisicoquímicos. Las mayores temperaturas se determinaron en la cuenca baja, lo que coincide con lo señalado por Medina et al. (2013), quienes indican que la temperatura aumenta desde la cuenca alta hasta la cuenca media y baja, ya que la misma depende de factores como altitud, latitud y caudal del río, los cuales pueden variar según las condiciones climáticas y geográficas de la zona. El pH presentó los máximos valores (8,55) en la cuenca alta cuyo relieve contiene rocas carbonatadas y la menor intervención antrópica; aguas cristalinas y en las riberas es habitual la vegetación boscosa y descienden hacia las cuencas media y baja.
En la cuenca existe una predominancia de rocas calcáreas indiferenciadas, situación que cambia más abajo, donde aparecen areniscas y conglomerados Medina et al. (2013). La meteorización de estas rocas produce iones carbonatos y especialmente bicarbonatos que incrementan la conductividad en agua en la cuenca alta, especialmente durante los meses de lluvia. De manera general las aguas de la cuenca están bien oxigenadas con una saturación superior al 70 %, la mayor concentración de oxígeno disuelto se registró en la cuenca alta (estación Las Trincheras, con 8,3 mg L-1), y está asociado a que es una zona, de riberas con vegetación boscosa con una alta tasa de fotosíntesis, además de la baja densidad poblacional que ha tenido poco impacto en las condiciones naturales del río y la calidad de sus aguas. Sin embargo, altos valores de DBO5 en la cuenca media y baja son reflejo de la mayor carga orgánica generada por la intervención antropogénica. Fuentes et al. (2008), realizaron un estudio fisicoquímico y bacteriológico del Manzanares, y determinaron valores de oxígeno disuelto desde 1,70 hasta 7,00 mg L-1, siendo la cuenca baja la más afectada por la abundante materia orgánica descompuesta y las temperaturas más cálidas. Las mayores concentraciones de sólidos se determinaron en la cuenca baja, seguida de la cuenca media y alta. Esto es causado por acumulación de sólidos procedentes de diferentes fuentes a lo largo del curso de los ríos, como aguas residuales, efluentes industriales, escorrentía agrícola y actividades mineras. La erosión causada por la deforestación y la agricultura en la cuenca media, aunado a la extracción de arena y grava del lecho del río, especialmente en la cuenca media y baja, contribuyen a la resuspensión de las partículas y al transporte a través del canal fluvial, como lo ha señalado Salazar et al. (2018) y Márquez et al. (2019).
La concentración de nutrientes nitrogenados inorgánicos fue mayor para las especies oxidadas siendo mayores los valores en la cuenca media y baja, evidenciando aportes antropogénicos y geológicos debido a la meteorización de los suelos y rocas. La presencia en la cuenca alta es causada por utilización de fertilizantes y material de origen biológico biodegradable.
Senior et al. (1998) realizaron estudios en la cuenca del Manzanares en la década de los 90. Este trabajo incluyó una serie de muestreos desde la cuenca alta hasta la baja, incluyendo la zona costera de la ciudad de Cumaná, y reportaron valores los siguientes promedios para toda la cuenca; 22-26 °C; 6,8 - 8,41 pH; 4-59 - 8,60 mg L-1 O2; 0,38 - 0,82 mg L-1 NT, 0,006 - 0,16 mg L-1 PT; 0,012 - 0,40 mg L-1 PO43-; 0,15 - 2,06 mg L-1 NO3-; 0,018 - 0,072 mg L-1 NH4+; 3,0 - 22,5 mg L-1 DBO5. Márquez et al. (2002), igualmente trabajaron en la cuenca baja, específicamente en la desembocadura y reportaron temperaturas entre 24,5 - 30,4 °C, 6,65 - 890 pH, 23 - 880 mg L-1 de sólidos suspendidos, 0,26 mg L-1 amonio. Investigaciones más recientes reportan caudales de 9,6x105 m3 día-1 para la cuenca alta, 3,5x106 m3 día-1 para la media y 3,4x106 m3 día-1 para la baja, así como rangos de temperaturas entre 23 – 26 °C en la cuenca alta, 27 - 28,5 °C en la media y entre 27 - 28 °C en la baja. Igualmente, rangos de pH de 8,97; 8,80 y 7,70 para las cuencas alta, media y baja respectivamente (Medina et al., 2013).
Cargas másicas de sólidos y nutrientes en las sub-cuencas del río Manzanares, y aportes hacia la zona marinos costeras y golfo de Cariaco
Las cargas másicas de sólidos totales en las cuencas alta, media y baja fueron 276,65; 715 y 2067 ton día-1 para septiembre de 2017 y 21,83; 189 y 331 ton día-1para abril del 2018, mientras que los sólidos suspendidos fueron de 18,60; 208 y 183 ton día-1 en septiembre y 1,06; 2,91 y 7,69 ton día-1 para abril del 2018, igualmente para los sólidos disueltos fue de 258; 507 y 1884 ton día-1 en septiembre de 2017 y 21,75; 185,64 y 323,46 ton día-1 en abril del 2018 (Figura 5A).
Para los nutrientes nitrogenados inorgánicos disueltos, el amonio presentó valores de 0,013; 0,032 y 0,13 ton día-1 en septiembre de 2017 y 0,0094; 0,077 y 0,045 ton día-1 en abril de 2018 para las cuencas alta, media y baja. Las de nitrito más nitrato (NO2-+NO3-) fueron 0,12; 0,49 y 1,01 ton día-1 en septiembre y 0,029; 0,37 y 0,22 ton día-1 en abril en las tres subcuentas (Figura 5B). Las cargas de nitrógeno total fueron de 0,22; 0,63 y 1,39 ton día-1 en septiembre y 0,057; 0,53 y 0,37 ton día-1 en abril en las cuencas alta, media y baja (Figura 5C). Las de fósforo inorgánico disuelto (PO43-) variaron de 0,037; 0,12; 0,30 ton día-1 en septiembre de 2017 a 0,0017; 0,026 y 0,035 ton día-1 en abril de 2018 en las tres sub-cuencas (alta, media y baja) (Figura 5B); mientras que las de fósforo total (PT) fueron 0,044; 0,16 y 0,32 ton día-1 y 0,0050; 0,051 y 0,069 ton día-1 en septiembre y abril respectivamente (Figura 5C). Por otra parte, las cargas de silicatos variaron de 0,34; 5,34 y 9,04 en septiembre de 2017 a 0,11; 2,01 y 11,27 en abril de 2018 en las cuencas alta, media y baja (Figura 5B). El orden de distribución para los dos meses septiembre de 2017 (S) y abril 2018 (A) para las tres sub-cuencas fueron: amonio cuenca alta S>A, media A>S, Baja S>A, nitrito +nitrato cuenca alta S>A, media S>A, baja A>S; nitrógeno total (NT), cuenca alta S>A, media S>A y baja S>A; para fosfato cuenca alta S>A, media S>A baja y baja S≤A; fósforo total (PT) cuenca alta S>A; media S>A , baja S>A, y para silicatos silicato cuenca alta S>A, baja S>A , baja S<A.
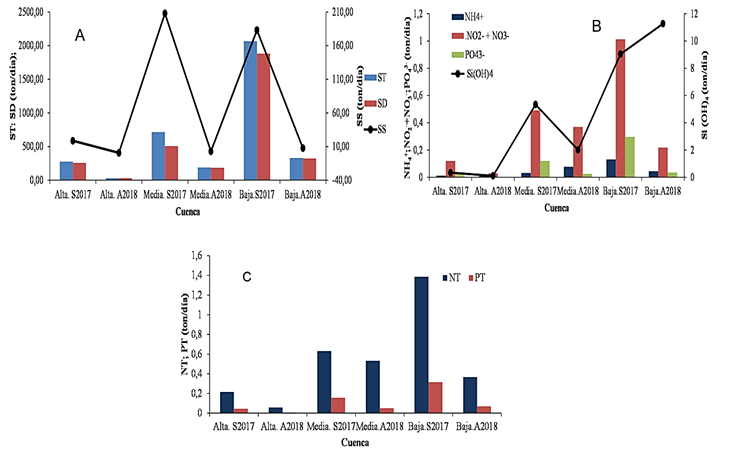
Figura 5. Variación de las cargas másicas de sólidos y nutrientes en las cuencas altas, media y baja del río Manzanares en septiembre de 2017 y abril de 2018.
Para los nutrientes nitrogenados inorgánicos disueltos, el amonio presentó valores de 0,013; 0,032 y 0,13 ton día-1 en septiembre de 2017 y 0,0094; 0,077 y 0,045 ton día-1 en abril de 2018 para las cuencas alta, media y baja. Las de nitrito más nitrato (NO2-+NO3-) fueron 0,12; 0,49 y 1,01 ton día-1 en septiembre y 0,029; 0,37 y 0,22 ton día-1 en abril en las tres subcuentas (Figura 5B). Las cargas de nitrógeno total fueron de 0,22; 0,63 y 1,39 ton día-1 en septiembre y 0,057; 0,53 y 0,37 ton día-1 en abril en las cuencas alta, media y baja (Figura 5C). Las de fósforo inorgánico disuelto (PO43-) variaron de 0,037; 0,12; 0,30 en septiembre de 2017 a 0,0017; 0,026 y 0,035 ton día-1 en abril de 2018 (cuencas alta, media y baja) (Figura 5B); mientras que las de fósforo total (PT) fueron 0,044; 0,16y 0,32 ton día-1 y 0,0050; 0,051 y 0,069 ton día-1 en septiembre y abril respectivamente (Figura 5C). Por otra parte, las cargas de silicatos variaron de 0,34; 5,34 y 9,04 en septiembre de 2017 a 0,11; 2,01 y 11,27 en abril de 2018 en las subcuencas alta, media y baja (Figura 5B). El orden de distribución para los dos meses septiembre de 2017 (S) y abril 2018 (A) para las tres sub-cuencas fueron: amonio cuenca alta S>A, media A>S, Baja S>A, nitrito +nitrato cuenca alta S>A, media S>A, baja A>S; nitrógeno total (NT), cuenca alta S>A, media S>A y baja S>A; para fosfato cuenca alta S>A, media S>A baja y baja S≤A; fósforo total (PT) cuenca alta S>A; media S>A , baja S>A, y para silicatos silicato cuenca alta S>A, baja S>A , baja S<A.
El aporte de sólidos desde la cuenca del río Manzanares hacia la zona costera y golfo de Cariaco en ton día-1 fue de 5.782 y 915 de solidos totales; 501 y 22 de sólidos suspendidos y 5281 y 823 de sólidos disueltos para septiembre de 2017 y abril de 2018 respectivamente (Tabla 2). Por otra parte, los aportes de nutrientes durante septiembre 2017 y abril de 2018 fueron de 0,36 y 0,12 ton día-1 de amonio; 2,67 y 0,54 ton día-1 de nitrito más nitrato, lo que hace un equivalente de 3,03 ton día-1 para septiembre y 0,66 ton día-1 para abril de nitrógeno inorgánico disuelto. Los aportes de nitrógeno total fueron de 3,55 y 0,92 ton día-1; mientras que el aporte de fósforo inorgánico disuelto (fosfato) fue de 0,82 y 0,10 ton día-1 y los de fósforo total de 0,87 y 0,20 ton día-1 (Tabla 2; Figura 5C). Por otra parte, las contribuciones de silicatos fueron de 15,32 y 32,99 ton día-1 para septiembre de 2017 y abril de 2018 respectivamente (Tabla 2; Figura 5B). Los aportes de silicato disminuyeron en la cuenca baja durante el mes de lluvia.
Tabla 2. Aportes de cargas másicas de sólidos y nutrientes (ton día -1) desde la cuenca del río Manzanares hacia la zona marino-costera y golfo de Cariaco. S2017=septiembre 2017; A2018=abril 2018
|
Muestreo |
ST |
SS |
SD |
NH4+ |
(NO2- + NO3-) |
NT |
PO43- |
PT |
Si(OH)4 |
|
S2017 |
5782 |
501 |
5281 |
0,36 |
2,67 |
3,55 |
0,82 |
0,87 |
15,32 |
|
A2018 |
915 |
22 |
893 |
0,12 |
0,54 |
0,92 |
0,10 |
0,20 |
32,99 |
Los aportes hacia la cuenca media y baja de los sólidos es originado en parte por la alta deforestación en la cuenca alta y cuenca media, mayormente en la media; al respecto entre 1985-2022 ha ocurrido una deforestación en la cuenca alta y media de 9.200 ha (https://venezuela.mapbiomas.org/), lo que representa cerca de 0,7 ha diarias, y por la presencia de empresas areneras que modifican los sedimentos del lecho del río (Márquez et al. 2000; Salazar et al., 2018; Márquez et al., 2019). La deforestación disminuye la infiltración y aumenta la escorrentía superficial, haciendo que no solamente los sedimentos sean arrastrados hacia la cuenca baja, sino también los nutrientes utilizados en la agricultura, y los generados por la degradación del material orgánico en las cuencas alta y media. Medina et al. (2013) indicaron que el transporte de nutrientes, aumentó hacia las cuencas media y baja del río Manzanares, debido principalmente a que presentaron los mayores caudales y se encuentran impactadas por la acción antropogénica; al aumentar el caudal y la densidad poblacional, también se ha incrementado el transporte de nutrientes.
Según el censo del año 2011 de la República de Venezuela, en la cuenca alta del río Manzanares, se asientan pequeñas poblaciones o caseríos como Cocollar, San Fernando y San Lorenzo (~19.000 habitantes, que se dedican principalmente a la agricultura y cría en pequeña escala de ganado. En la cuenca media se desarrollan actividades agrícolas y ganaderas en mayor escala y se encuentran poblados como Arenas, Aricagua, Quebrada Seca y Cumanacoa, con una población total de ~27.000 habitantes. La cuenca baja es la de mayor población (~357.000 habitantes), localizándose la principal (capital) ciudad del estado, Cumaná. Allí esencialmente se desarrollan actividades industriales y de comercio (http://www.ine.gov.ve). Los autores reportaron un transporte medio mensual de 131.282 kg mes-1 (2,18 ton día-1) de nitrato, 106.504 kg mes-1 (1,78 ton día-1) de amonio, y 25.252 kg mes-1 (0,42 ton día-1) de fosfato; valores que son superiores a 1,56 ton día-1 de nitrato, 0,24 ton día-1 de amonio y comparables con los valores de 0,46 ton día-1 de fosfatos obtenidos en esta investigación. Los resultados de esta investigación demuestran que la influencia y descarga de nutrientes del río Manzanares sobre la zona costera, se ha sobre la zona costera y el golfo de Cariaco se ha incrementado significativamente desde 1972 hasta el presente. Alvarado (1976) reportó una descarga total de nitrógeno inorgánico durante el año 1972 de 73, 800 kg mes-1 (0,0025 ton día-1), la cual es una cifra inferior a la registrada durante el presente estudio que es de 1,85 ton día-1. Según los resultados obtenidos en esta investigación, la descarga de nitrógeno inorgánico ha sufrido un incremento superior al 700 % en los últimos 48 años (desde el año 1976 hasta 2018-2018).
En otros estudios realizados en Venezuela, Rivas et al. (2009) evaluaron las sub-cuencas de los ríos Limón, Palmar, Santa Ana, Catatumbo, Escalante, Chama, Motatán, Misoa, Machango y Pueblo Viejo, ríos que descargan al lago de Maracaibo, y señalaron un enriquecimiento por nutrientes y eutrofización en las aguas retenidas en las desembocaduras. Determinaron que el promedio de nitrógeno y fósforo total de los ríos fue 1,20 y 0,84 mg L-1 respectivamente. Igualmente Rivas et al. (2005 y 2006) reportaron cargas másicas (ton día-1) de NT y PT para los ríos Santa Ana (19,63 NT, y 3,15 PT), Catatumbo (53,45 NT y 18,87 PT), Escalante (8,61, 2,26), Chama (9,65 NT y 4,26 PT) y Motatan (3,37 NT y 1,57 PT); estos valores son superiores a los determinados en esta investigación. Otros ríos impactados por nutrientes en Venezuela, son el Aroa y Yaracuy en los estados Falcón y Yaracuy (Espinoza y Rodríguez, 2016), el río Chirgua en Bejuma, estado Carabobo (Fernández et al., 2017), y el río Guarapiche, estado Monagas (Gil et al., 2018).
Indicador del potencial de eutrofización costera (ICEP)
Los rendimientos específicos promedio para nitrato-N, fosfato-P y sílice-Si disuelto en la desembocadura del río Manzanares fueron de 1,45; 0,38 y 1,60 kg km-2 día-1 en septiembre 2017 y 0,37, 0,06 y 19,42 kg km-2 día-1 para abril del 2018 respectivamente. Por otra parte, los valores de N-ICEP y P-ICEP fueron de 4,60 y 11,76 kg C km-2 día-1 en septiembre de 2017 y en abril de 2018 fueron -41,99 N-ICEP y -41,85 P-ICEP kg C km-2 día-1 (Tabla 3). Para septiembre de 2017 el aumento de N-ICEP (N-ICEP>0) indicó la presencia de un exceso de nitrógeno sobre la sílice, este incremento se asocia principalmente al incremento de nitrógeno debido a con factores antropogénicos, que puede ser de la agricultura y la descarga de aguas residuales de las áreas urbanas. Esto lo que puede favorecer el crecimiento de especies de fitoplancton no silíceas distintas de las diatomeas y procesos de eutrofización en las aguas receptoras del río Manzanares.
Tabla 3. Valores de rendimiento específico de nutrientes (kg C km-2 día-1) de N-ICEP y P-ICEP en aguas descargadas desde la cuenca del río Manzanares a la zona marino costera y golfo de Cariaco .
|
Muestreo |
Drenaje (km2) |
NI (kg km-2 día-1) |
PI (kg km-2 día-1) |
SiI (kg km-2 día-1) |
N-ICEP (kgC km-2 día-1) |
P-ICEP (kgC km-2 día-1) |
|
S2017 |
1 652 |
1,45 |
0,38 |
1,60 |
4,60 |
11,76 |
|
A2018 |
1 652 |
0,37 |
0,06 |
19,42 |
-41,99 |
-41,85 |
S2017=septiembre de 2017; A 2018=abril de 2018: NI=NO2-+NO3-+NH4+; PI=PO43-; SiI=Si(OH)4
El valor positivo de P-ICEP indicó que para ese mes no hubo limitación por fósforo, lo cual es ideal para el desarrollo de cianobacterias. Una nueva producción de algas no silíceas, normalmente restringida a la producción regenerada, es característica común de la eutrofización costera la cual puede producir manifestaciones muy diversas como la acumulación de material mucilaginoso, producción de toxinas, o déficits de oxígeno causados por la degradación de la biomasa acumulada (Gilles y Garnier, 2007 y 2022). Para abril del 2018, la situación fue diferente, tanto N-ICEP como P-ICEP<0, lo cual indica que el sílice está presente en exceso con respecto a los otros nutrientes (N y P), por lo tanto caracteriza la ausencia de problemas de eutrofización. Los resultados son concordantes con lo apreciado en la Figura 4G. Probablemente este exceso de silicatos en abril, sea originado por el aporte desde la surgencia costera que ocurre en los primeros meses del año en la zona marina, la cual enriquecen a las aguas receptoras del río Manzanares. Al respecto, Márquez et al. (2011) señalan que, durante el período de surgencia, las aguas de fondo emergen a la superficie e incrementa la concentración de silicatos en las aguas superficiales de la zona costera y del golfo de Cariaco durante los primeros meses del año.
Dodds et al. (1998) y Dodds y Smith (2016) realizaron una clasificación para el estado trófico de los ríos en función de las concentraciones de NT y PT (mg L-1), ultraoligotrófico (<0,004 PT); oligotrófico (0,004-0,01 PT; 0,001-0,050 NT), mesotrófico (0,01-0,035 PT; 0,060-0,20 NT); eutrófico (0,035-0,10 PT; >0,20 NT), hipertrófico (>0,10PT; >1,5NT), según estos rangos de valores, las tres sub-cuencas del río Manzanares presentan características de eutrofizadas (0,033 PT; 0,43 NT cuenca alta; 0,037 PT; 0,24 NT), cuenca media y (0,046 PT, 0,38 NT) cuenca baja. Estos valores son consistentes con lo apreciado en los valores de I-CEP determinados para el río Manzanares en esta investigación.
La cantidad de nutrientes (N, P, Si) transportados a la zona costera por los grandes sistemas fluviales, así como el equilibrio entre estos son los principales determinantes de los problemas de eutrofización marina costera. Muchos de estos problemas son consecuencia de la nueva producción de algas no silíceas, sostenida por el nitrógeno y el fósforo aportados por los ríos en exceso sobre el sílice disuelto, con respecto a los requisitos para el crecimiento de diatomeas (Seitzinger et al., 2002; Gilles y Garnier, 2007). Gilles y Garnier, (2007) estudiaron los sistemas fluviales de los ríos Sena y Escalda (Francia)y muestran que, ya a principios del siglo XIX, tanto el nitrógeno como el fósforo llegaron a la zona costera en exceso respecto al sílice. Indicaron que flujos de fósforo han disminuido muy rápidamente, en gran parte como resultado de un mejor tratamiento de las aguas residuales urbanas y la consiguiente prohibición de los polifosfatos en los detergentes, mientras que el suministro de nitrógeno sigue siendo elevado debido a las prácticas agrícolas intensivas, creando una situación biogeoquímica sin precedentes en la zona costera, con baja contaminación de fósforo pero alta contaminación de nitrógeno. Royer (2020) calculó el ICEP para la cuenca del río Mississippi-Atchafalaya y cuatro sub-cuencas: Ohio-Tennessee, Missouri, Cuencas del Alto Mississippi y Arkansas-Red desde los años 1979 a 2015 y reportaron un desequilibrio en P-ICEP y N-ICEP que indicó condiciones favorables para cianobacterias en el Alto Mississippi, Ohio-Tennessee y el norte del Golfo de México. Ravi et al. (2021) encontraron valores negativos de P-ICEP y positivos de N-ICEP, indicando un exceso de nitrógeno sobre el transporte de sílice desde el río Ghaghara al río Ganges (India), y señalaron que esto puede crear un problema de eutrofización en el río Ganges.
Las cargas de sílice (Si), nitrógeno (N) y fósforo (P) las cargas y la estequiometría son factores clave que controlan el estado trófico de las zonas costeras. En la zona de la pluma de los grandes ríos que drenan intensamente cuencas hidrográficas pobladas o cultivadas intensivamente, el aumento de la carga de nutrientes ha resultado en graves problemas de eutrofización. Una mayor entrega de nutrientes al océano costero, se reconoce como una importante amenaza para la estructura y función de los ecosistemas de las zonas costeras cercanas (Seitzinger et al., 2002; Scibona et al., 2022). Okuda et al. (1978) señalaron que el efecto fluvial del río Manzanares sobre las condiciones hidrográficas del golfo de Cariaco (Venezuela) no era significativo, y que sus aguas no eran afectadas por el drenaje de los ríos. Estos autores concluyeron que las condiciones hidrográficas y la alta productividad de este golfo dependían del fenómeno de surgencia costera relacionada estrictamente con el régimen de los vientos alisios y del intercambio de agua con el exterior a través de la boca del golfo. Luego de 46 de ese estudio se aprecia que las condiciones han variado y que hay un efecto negativo de la descarga del río Manzanares sobre la zona costera, especialmente durante los meses de lluvia. Esto es confirmado por los valores de I-CEP obtenidos en esta investigación.
Factores que controlan la química de los nutrientes en la cuenca del río Manzanares
La distribución en los valores de los componentes principales C1 y C2 refleja la complejidad en la química del agua, así como de la geología de la cuenta, que incluye su relieve, tipo de suelos y vegetación. Las proyecciones ortogonales para los dos primeros componentes principales (ACP), mostraron para el mes de septiembre del 2017 (período de lluvia), que los dos primeros componentes explican el 55,51 % de la varianza total de los datos y para abril del 2018 el 60,46 %, siendo en ambos casos el componente C1 es mayor peso para explicar las variaciones observadas en la distribución de los diferentes parámetros fisicoquímicos. En septiembre las mayores contribuciones de las variables (%) al componente C1 fueron el pH> t> C.E>O2sat, mientras que las de los nutrientes fueron menores siguieron un orden PO43- > NOx > Si(OH)4->NH4+ (Figura 6A).
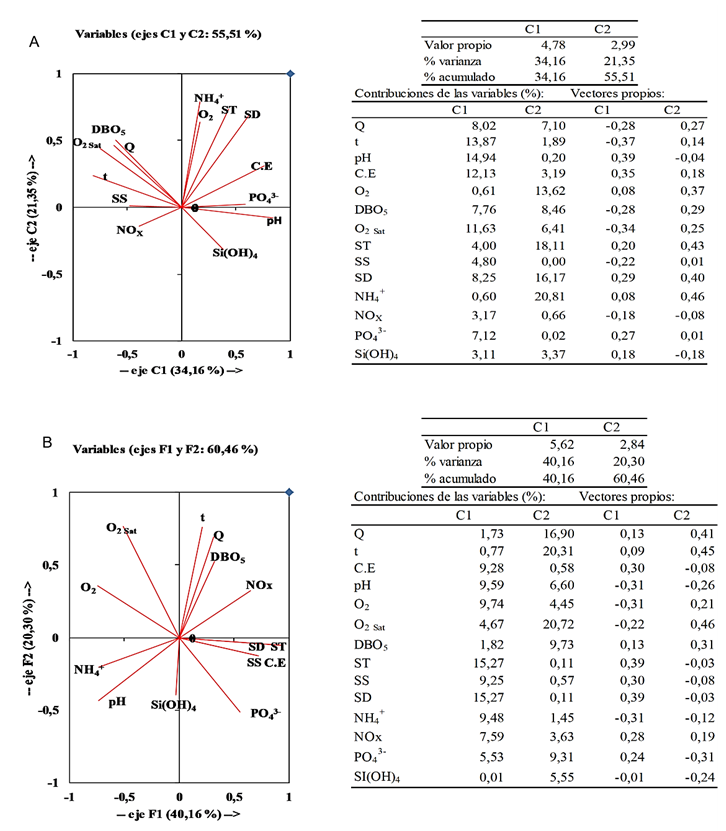
Figura 6. Proyección ortogonal de los dos primeros componentes principales para los parámetros fisicoquímicos de las aguas de la cuenca del río Manzanares, septiembre 2017 (A) y abril 2018 (B)
En C1 se orientan de manera positiva amonio, O2, CE, ST, SD, pH y los PO43, NH4+ y silicatos, mientras que inversamente se encuentran Q, t, DBO5 y NOx. En el componente C2 ambos, NOx y pH aparen asociados de manera opuesta a DBO5, O2sat, SS lo cual indica que hay procesos reductivos que degradan la materia orgánica reducen las especies oxidadas de nitrógeno NOx e incrementan las concentraciones de amonio, la cual representa la especie reducida del nitrógeno; igualmente producen un descenso en el pH. Las concentraciones de O2 - O2 sat y DBO5 se asocian de manera inversa al componente C1 lo que indica lo que indica el efecto de carga orgánica y su posterior mineralización. La DBO5 puede ser utilizada como un proxy que implica la carga orgánica en las aguas. Esta observaciones son corroboradas con las correlaciones (r) significativas observadas: pH- Q= -0,68; O2sat- Q =0,64; DQO5-Q = 0,77; CE-t= -0,65, O2 sat-t= 0,82; pH-CE= 0,66, CE-SD= 0,58, pH-DBO5=-0,72; =O2sat-Q=0,62; PO43- -O2sat =-0,64; PO43- -t= -0,78; ST-SD= 0,94; NOx- SS= 0,85; Si(OH)4-NOx=0,61; SS-SD- NH4+= 0,59. Las correlaciones sugieren que la materia orgánica se incrementa con el caudal, y la que su degradación (> DBO5) disminuye el pH. El NH4+ proviene en su mayoría de los fertilizantes y aguas residuales. Por otra parte, en C1 la temperatura se encuentra del mismo lado que DQO5 indicando que la degradación de materia orgánica incrementa con la temperatura y esto crea un consumo del oxígeno disuelto. La temperatura además aparece de lado opuesto a O2 indicando las aguas de menor temperatura contienen mayores concentraciones de oxígeno.
La correlación O2 sat-t= 0,82 y que existen procesos bacterianos en la cuenca alta (bajan la saturación), y la influencia de los procesos fotosintéticos sobre las concentraciones de oxígeno disuelto hacia la cuenca media y baja, esto es corroborado con lo apreciado en la Figura 2E. Las correlaciones pH-DBO5=-0,72, NOx- SS= 0,85, Si(OH)4-NOx=0,6 indican contribución de la lixiviación del suelo y sedimentos presentes en la zona de captación y cauce del río, es decir aportes de nutrientes desde los SS que a medida que aumentan aumenta los valores de SS, crecen las especies oxidadas de nitrógeno medida (NOx) y aumenta también los silicatos, sin embargo, las concentraciones de silicato son independientes del caudal. Por otra parte, una mayor cantidad de fosfato está asociada con menores temperaturas, ya que las correlaciones indican que el fosfato disminuye con la menor saturación de oxígeno de las aguas. El oxígeno de saturación se correlacionó positivamente con el caudal. La relación Si(OH)4-NOx=0,60 sugiere producción interna de diatomeas, probablemente en zonas diferentes a la desembocadura. La correlación CE-SD= 0,58 mostró carga positiva para la CE y TDS, y puede atribuirse a la contribución de la meteorización química en la zona de captación junto con el aporte de las precipitaciones. La combinación de las correlaciones CE-SD=0,58, NOx- SD=0,6, SD-NOx= 0,61 y Si(OH)4-NOx=0,61, SS-SD- NH4+= 0,59 sugieren la contribución a todas las especies del nitrógeno (oxidadas y reducidas) y de silicio, y su posterior mineralización, desde la meteorización química del suelo y sedimentos presentes en la zona de captación y cauce del río. Las variaciones en el SS influyen en contenidos de elementos de nitrógeno y fósforo (Li et al., 2022).
Para abril del 2018, el cual representa el mes de sequía (Figura 6B) las variables en C1 presentaron las mayores contribuciones en ST=SD>SS siendo la contribución para los nutrientes NH4+ > NOx > PO43- > Si (OH)4. En los cuadrantes positivos tal como lo demuestran los vectores propios, t, Q, DBO5, NOx se orientan en la misma dirección, y todos los sólidos más la conductividad y fosfato apuntan en dirección contraria, tal como se evidencia en los vectores propios. En los cuadrantes negativos de C1 aparecen O2, O2 sat, NH4+ y pH, estos dos últimos apuntan en dirección contraria a los primeros. La asociación entre la temperatura, oxígeno disuelto y O2sat, son similares a lo observado para el mes de septiembre y representan los mismos procesos biogeoquímicos que ocurren en ese mes. En C2 las especies reducidas den nitrógeno (NH4+) y pH posicionan inversamente a las concentraciones de oxígeno (O2) y a NOx indicando procesos de reducción del nitrógeno. Las correlaciones significativas (r) observadas fueron DBO5-Q=0,69, CE-O2=-0,65; CE-SD=0,69; SD y ST-O2=-0,71; PO43--O2sat=-0,80; pH- SD =-0,65; pH-DBO5= -0,72; CE- SD=0,69; SD-O2=-0,71; SD- PO43- =0,50; NH4+ -pH= 0,67; NH4+-NOX= -0,51; NH4+ -ST y SD-SS= 0,50; NH4+ -SS=-0,55; NOx-ST y SD=0,61. SD-NOx= 0,61; SD- PO43- =0,50.
La representación en los componentes y las correlaciones indican que la materia orgánica, representada por la DBO5, se incrementa con el caudal, pero la relación es menor que en septiembre. Las correlaciones negativas pH-DBO5= -0,72, NH4+-NOX= -0,51 indica el aporte de aguas residuales de la zona de captación; igualmente SD-SS= 0,50; NH4+ -SS=-0,55 sugieren aportes desde los SD y consumo desde los SS, posiblemente por la degradación de estos. El NH4+ proviene no solo de los fertilizantes, sino también del aporte de aguas residuales y la degradación de la materia orgánica; a medida que se reducen las especies oxidadas de nitrógeno (NOx) aumenta la concentración de amonio. Los valores de fosfato disminuyen con la menor saturación de oxigeno de las aguas. Las concentraciones de silicato no dependieron de la magnitud del caudal, al igual que ocurrió en septiembre, sus concentraciones son reflejo de la geología de la cuenca. La correlación CE- SD=0,69 puede atribuirse a la contribución de la meteorización química en la zona de captación. La combinación de las correlaciones CE-SD=0,69NOx- SD=0,6, SD-NOx= 0,61 sugieren la contribución de la meteorización química a la concentración de las formas de nitrógeno oxidadas (NOx) y su posterior mineralización.
Según Hillebrand et al. (2014) y Semenov et al. (2024), la abundancia de nutrientes y estequiometría en los ecosistemas acuáticos se ven afectados por la hidrología y los procesos biogeoquímica en el propio sistema acuático, y por la escorrentía fluvial, que sufre grandes variaciones y desequilibrios debidos al suelo y su uso en la cuenca. El amonio y nitrato son las especies más dominantes del nitrógeno inorgánico disuelto en el ecosistema acuático (Ravi et al. 2021), y a diferencia de sistemas muy afectados por el hombre, nitrógeno reactivo se presenta principalmente como nitrato disuelto (NO3−) y en menor medida, como amonio disuelto (NH4+), siendo ambos iones asimilados por los productores primarios, lo que lleva a la posterior sedimentación del nitrógeno. Además, en condiciones óxicas, el amonio puede ser oxidado a nitrato que es muy soluble; igualmente en condiciones anóxicas, el nitrato puede reducirse mediante desnitrificación a nitrógeno gaseoso (N2), a través de una reducción de varios pasos que también incluye la formación del N2O que es un gas de efecto invernadero (Baron et al. 2013, Scibona et al.2022). Fósforo (P) y sílice (Si) tienen una estructura y un ciclo predominantemente sedimentario con una alta fracción de partículas que tiende a sedimentarse (Scibona et al., 2022). La sílice disuelta es un micronutriente esencial para el crecimiento de diatomeas, radiolarios y esponjas en el ecosistema acuático. Su origen es principalmente geogénico y se produce de la erosión química de las rocas y el suelo presentes sobre la superficie de la tierra; sin embargo, el ciclo de la sílice biogénica también puede ser un importante contribuyente al flujo de sílice en el sistema fluvial (Durr et al., 2011; Ravi et al., 2021). En aguas abiertas, la sílice disuelta (SiD) se libera continuamente y es asimilado por diatomeas fitoplanctónicas y otras especies para formar sílice biogénica (SiB), que se asienta después de que los organismos mueren y se acumula en las aguas de fondo y sedimentos, donde está parcialmente retenido (Hobbs et al., 2010; Frings et al., 2014; Scibona et al., 2022). Por otra parte, el fosfato actúa como un nutriente limitante para la actividad biológica en los cuerpos de agua superficiales, debido a su tendencia a precipitar con los minerales. La retención de P se debe a la asimilación por el fitoplancton, junto con los procesos físico-químicos, como la adsorción y la coprecipitación, especialmente con metales (es decir, hierro, aluminio y calcio), seguido por sedimentación y entierro en los sedimentos (Reynolds y Davies, 2001; Serediak et al., 2014, Ravi et al., 2021; Scibona et al., 2022). La masa de fósforo adsorbido está limitada por la solubilidad de sus minerales más estables, siendo la acidez uno de los factores clave en su movilización desde los compuestos que contienen fósforo. La forma disuelta reactiva está presente en altas concentraciones en el agua residual, debido al aporte de los detergentes; de igual manera, la apatita es el principal mineral de fósforo en todo tipo de estructuras ígneas, metamórficas y rocas sedimentarias. En rocas ígneas, la apatita representa del 1,7 al 5,7% del fósforo total, mientras que, en los carbonatos sedimentarios, arcillosos, y rocas arenosas, la apatita contiene 22,9, 0,5 y 7,1% de fósforo, respectivamente (Savenko y Savenko, 2022).
CONCLUSIONES
Los nutrientes son esenciales para la salud de los ecosistemas, pero su exceso puede tener efectos perjudiciales para la salud humana y la ecología de los sistemas de aguas superficiales. Es evidente que la calidad física y química del agua está relacionada con los eventos que ocurren en la cuenca y depende en gran medida del uso del suelo, del tratamiento de los efluentes de aguas servidas y del control de la erosión, entre otros. Se recogieron y analizaron muestras de agua para comprender la dinámica de los nutrientes en la cuenca del río Manzanares; los resultados indicaron que las variables fisicoquímicas en las aguas de la cuenca se asocian con los regímenes climáticos, geológicos y antrópicos de cada sub-cuenca. Los compuestos de nitrógeno y fósforo presentaron variaciones significativas en los meses estudiados, mientras que en las sub-cuencas solo se apreciaron diferencias estadísticas en el amonio, nitrito y fosfato, siendo la concentración de nitrato el componente principal de la carga de nitrógeno inorgánico disuelto (NID), y el fósforo el elemento limitante en la mayor parte de la cuenca. Algunos de los factores que modifican las concentraciones y cargas másicas de los nutrientes dentro de la cuenca del Manzanares, incluyen, incremento de los caudales de los ríos que componen la cuenca, procesos de meteorización de los suelos, aportes de cargas orgánicas de origen natural y antropogénico, y mineralización de materia orgánica.
La cuenca, se comporta como un ecosistema eutrofizado, siendo sus cargas másicas de nutrientes, comparables con estudios previos reportados para la cuenca en la década pasada, sin embargo, se aprecia un incremento superior al 700% que los flujos de nitrógeno inorgánico en los últimos 48 años (desde el año 1976 hasta 2018; datos de esta investigación). Estas cargas están en consonancia con el caudal de los diferentes ríos que componen la cuenca, y con el mayor asentamiento humano establecido en las diferentes su-cuencas. La relación decreciente de SiD: NID a lo largo del tramo de la desembocadura del río Manzanares indicó la existencia de un aumento de carga de nitrógeno en el sistema del río, lo cual hizo que los valores de N-ICEP y P-ICEP fueran positivos durante el período de lluvia, confirmando que el efecto del transporte de nitrógeno desde la cuenca del río Manzanares tiene el potencial de crear un problema de eutrofización en los cuerpos de agua receptores (aguas costeras de la ciudad de Cumaná y el golfo de Cariaco); con posibles impactos de floraciones de algas nocivas (FAN). Los resultados indican que se requieren medidas de remediación para reducir la carga de nitrógeno procedente de las diferentes fuentes.
AGRADECIMIENTOS
A la División Costa Afuera Oriental, Gerencia de Ambiente División Costa Afuera Oriental de PDVSA Esta investigación fue realizada con datos históricos del proyecto: Servicio de análisis fisicoquímico y microbiológico de aguas superficiales, efluentes y sedimentos, llevado a cabo por la División Costa Afuera Oriental, Gerencia de Ambiente División Costa Afuera Oriental de PDVSA, la cual fue desarrollado por el Departamento de Oceanografía del Instituto Oceanográfico de Venezuela.
LITERATURA CITADA
Adamczuk, M., Ferencz, B., Mieczan, T. & Dawidek, J. (2019). Allochthonous subsidies as driving forces for the development of plankton in an autotrophic, temperate, and small lake. Hydrobiologia. 846, 59–73. http://dx.doi.org/10.2139/ssrn.3817260
Alvarado, E. (1976). Algunas observaciones sobre la descarga de nitrógeno del río Manzanares. Cumaná-Venezuela. Trabajo de Grado. M. Sc. Ciencias Marinas, Universidad de Oriente, Cumaná, Venezuela, 23 pp.
Aminot, A. & Chaussepied, M. (1983). Dosage del’ Oxygéne dissous. En: Manuel des Analyses Chimiques en milieu Marin. Centre National Pour L’¨Explotation des Oceans, IN: Aminot, A & Chaussepied, M. (Eds), France. CNEXO.
APHA (1995) Standard Methods for the Examination of Water and Wastewater, (19 Eds), American Public Health Association Inc., New York.
Baron, J. S., Hall, E. K, Nolan. B. T., Finlay, J. C., Bernhardt, E. S., Harrison, J. A., Chan, F. & Boyer, E. W. (2013) The interactive effects of excess reactive nitrogen and climate change on aquatic ecosystems and water resources of the United States. Biogeochemistry,114:71–92. https:// doi. org/ 10. 1007/ s10533- 012- 9788-y
Bendschneider, K. & Robinson, R. (1952). A new spectrophometric determination of nitrite in sea water. Journal of Marine Research, 11:87-96. https://elischolar.library.yale.edu/journal_of_marine_research/761
Beusen, A. H., Doelman, J. C., Van Beek, L. P., Van Puijenbroek, P. J., Mogollón, J. M. & Van Grinsven, H. J. (2022). Exploring river nitrogen and phosphorus loading and export to global coastal waters in the Shared Socio-economic pathways. Global Environ. Change, 72. 102426. https://doi.org/ 10.1016/j.gloenvcha.2021.102426
Beusen, A.H. & Bouwman, A, F. (2022) Future projections of river nutrient export to the global coastal ocean show persisting nitrogen and phosphorus distortion. Frontiers in Water. 4:893585. https://doi.org/ 10.3389/frwa.2022.893585
Castro-Moreno, A., Contreras-Gaspar, R., Pérez-Gómez, L., Cotoret- Brito, I., Cerillos, M. L., Torres-Arzayus, P., Zamora, R. & Arcia, D. (2017). En: Cumaná 500 años: una historia ilustrada. Banco Interamericano de Desarrollo (Eds). Programa Ciudades Emergentes y Sostenibles, Primera Edición. https://drive.google.com/file/d/13qaqj5F88NUQ2zrS3QTMzYdeJP8MvDqy/view
Chow, V. (1994). Hidráulica de canales abiertos. McGraw (Hill Eds), Colombia.
Dai, M., Su, J., Zhao, Y., Hofmann, E., Cao, Z., Cai, W. J., Gan, J., Lacroix, F., Laruelle, G. G., Meng, F., Müller, J. D., Regnier, P. A., Wang, G. & Wang, Z. (2022). Carbon Fluxes in the Coastal Ocean: Synthesis, Boundary Processes, and Future Trends. Annual Review of Earth and Planetary Sciences. 50: 593–626. https://doi.org/10.1146/annurev-earth-032320-090746
DECRETO 883. (1995). Gaceta Oficial de la República de Venezuela de 1995. Normas para la clasificación y el control de la calidad de los cuerpos de agua y vertidos o efluentes líquidos en Venezuela. https://www.fao.org/faolex/results/details/es/c/LEX-FAOC174040/
Dodds, W., Jones, J. R. & Welch, E. B. (1998). Suggested classification of stream trophic state: distributions of temperate stream types by chlorophyll, total nitrogen, and phosphorus. Water Research. 32: 1455–1462. http://dx.doi.org/10.1016/S0043-1354(97)00370-9
Dodds, W. & Smith, V.H. (2016). Nitrogen, phosphorus, and eutrophication in streams. Inland Waters. 6: 155-164. https://doi.org/ 10.5268/IW-6.2.909
Durr, H. H., Meybeck, M., Hartmann, J., Laruelle, G. G. & Roubeix, V. (2011). Global spatial distribution of natural riverine silica inputs to the coastal zone. Biogeosciences, 8: 597–620.
Elizalde, G., Viloria, J. & Rosales, A. (1985). Geografía de suelos de Venezuela. En: Geo. Venezuela. Fundación Empresas Polar (Eds). Caracas Venezuela.https://bibliofep.fundacionempresaspolar.org/media/1016/gv_t2_c15_p402_537_lres_single_preview.pdf
Espinosa, T. & Rodríguez, C. (2016). Nota técnica: Índice de calidad del agua (ICA), de los ríos Aroa y Yaracuy de los estados Falcón y Yaracuy, en Venezuela. Revista Ingeniería UC, 23 (3): 381-386
Fagodiya, R. K., Pathak, H., Kumar, A., Bhatia, A. & Jain, N. (2017). Global temperature change potential of nitrogen use in agriculture: a 50-year assessment. Scientific Reports, 7: 44928. https:// doi. org/ 10. 1038/ srep4 4928
Fernandez, R., Vincenzo, S. & Smits Briedis, G. (2017). Evaluación de los hifomicetos acuáticos como bioindicadores de calidad ambiental en el Río Chirgua (Bejuma, Venezuela). Gestión y Ambiente, 20(1): 82-94
Frings, P. J., Clymans, W., Jeppesen, E., Linding Lauridsen, T., Struyf, E. & Conley, D. J. (2014). Lack of steadystate in the global biogeochemical Si cycle: emerging evidence from lake Si sequestration. Biogeochemistry, 117:225–277. https:// doi. org/ 10. 1007/ s10533- 013- 9944-z
Fuentes, M. V., Senior, W., Fermín, I., & Troccoli, L. (2008). Estudio fisicoquímico y bacteriológico del Río Manzanares, Estado Sucre, Venezuela. Boletín del Instituto Oceanográfico de Venezuela. 47 (2): 149-158.
Galloway, J. N., Townsend, A. R., Erisman, J. W., Bekunda, M., Cai, Z., Freney, J. R., Martinelli, L. A., Seitzinger, S. P. & Sutton, M. A. (2008). Transformation of the nitrogen cycle: recent trends, questions, and potential solutions. Science, 320, 889–892. https://doi.org /10.1126/science.1136674
Garnier, J., Beusen, A., Thieu, V., Billen, G. & Bouwman, L. (2010). N:P:Si nutrient export ratios and ecological consequences in coastal seas evaluated by the ICEP approach. Global Biogeochemical Cycles, 24, GB0A05. https://doi.org/10.1029/2009GB003583
Gil-Marín, J., Vizcaino, C. & Montaño-Mata, N. (2018). Evaluación de la calidad del agua superficial utilizando el índice de calidad del agua (ICA). Caso de estudio: Cuenca del Río Guarapiche, Monagas, Venezuela. Anales Científicos, 79 (1): 111 – 119.
Gilles, B. & Garnier, J. (2007). River basin nutrient delivery to the coastal sea: Assessing itspotential to sustain new production of non-siliceous algae. Marine Chemistry, 106: (1&2). 148-160. https://doi.org/10.1016/j.marchem.2006.12.017
Gilles, B. & Garnier, J. (2022). The water-agro-food system: upscaling from theSeine river basin to the global scale. Comptes Rendus Géoscience - Sciences de la Planète. 1-15. https://doi.org/10.5802/crgeos.141
Glibert, P. M. (2019). Harmful algae at the complex nexus of eutrophicationand climate change. Harmful Algae, 91, 101583. https://doi.org/10.1016/j.hal.2019.03.001
Hem, J. D. (1970). Study and Interpretation of the Chemical Characteristics of Natural Water, (2 Eds). Geological Survey Water-Supply Paper 1473. U.S. Government Printing Office, Washington, DC, USA.
Hillebrand, H., Cowles, J. M. & Lewandowskam, A. (2014) Think ratio! A stoichiometric view on biodiversity-ecosystem functioning research. Basic and Applied Ecology, 15:465–474. https:// doi. org/ 10. 1016/j. baae. 2014. 06. 003
Hobbs, W. O., Lalonde, S. V., Vinebrooke, R. D., Konhauser, Kurt O.; Weidman, P., Graham, R., M. D. & Wolfe, A. P. (2010) Algalsilica cycling and pigment diagenesis in recent alpine lake sediments: Mechanisms and paleoecological implications. J Paleolimnol. 44:613–628. https:// doi. org/ 10. 1007/s10933- 010- 9441-5
http://www.ine.gov.ve. Instituto nacional de la República de Venezuela: Censo de población y vivienda. Fecha de consulta; abril del 2024.
https:// venezuela.mapbiomas.org. Datos y mapas del territorio venezolano. Fecha de consulta: abril del 2024.
Johnson, R. A. & Wichern, D. W. (1992). Applied multivariate statistical analysis, (3 Eds). Prentice Hall International (Eds). New York, USA.
Ke, S., Cai, Z., Zhang, P., Zhang, J. & Zhang, J. (2023). Effects of river input flux on spatiotemporal patterns of total nitrogen and phosphorus in the Pearl River Estuary, China. Frontiers in Marine Science. 10:1129712. https:// doi. org /10.3389/fmars.2023.1129712
Koroleff, F. (1976). Determination of nutrients. In: Methods of Seawater Analysis, Grasshoffm, K. Verlag Chemie (Eds), Weinheim, Germany; New York, USA.
Li, S., Yang, X., Huang, H., Liang, X., Wang, R. & Feng, B, (2022) Variations in the Suspended Sediment concentration in Mountain-Type Rivers Flowing Into the Sea in the Past 60 years-Taking Nanliu River in Beibu Gulf as an Example. Frontiers in Earth Science. 10:913022. https:// doi. org / 10.3389/feart.2022.913022
Márquez, A., Senior, W. & Martínez, G. (2000). Concentraciones y comportamiento de metales pesados en una zona estuarina de Venezuela. Interciencia. 25 (6): 284-291.
Márquez, A., Senior, W., Martínez G. & Castañeda, J. (2002). Environmental conditions of the waters of the Manzanares River, Cumana-Sucre, Venezuela. Boletín del Instituto Oceanográfico de Venezuela. 41 (1 y 2): 15-24.
Márquez, A., Fermín, I., Senior W., De La Cruz, R., Benítez, A., Díaz, A., González, E., Hernández, E., González, M., Hernández, D., Ocque, M., Acosta, J. Lemus, A., Patiño, M. & Rodolfo O. (2019). Evaluación de riesgo ambiental por metales pesados en sedimentos de la cuenca del río Manzanares, Venezuela. En: Botello A., V. & Villanueva, S. (Eds.). Las costas mexicanas, contaminación, impacto ambiental, vulnerabilidad y cambio climático. UAC, UNAM, México.
Márquez, A., Senior, W., Benítez, A., Fermín I., Martínez, G., González, Á, Castañeda, J., Alcalá, L. & de la Cruz, R. (2011). Sector oriental del golfo de Cariaco, Venezuela. Una descripción de su dinámica hidroquímica, procesos, y del rol de la surgencia costera estacional. Boletín del Instituto Oceanográfico de Venezuela, 50, 2, 255-272.
Martínez, G. & Senior, W. (2001). Especiación de metales pesados (Cd, Zn, Cu y Cr) en el material en suspensión de la pluma del Río Manzanares, Venezuela. Interciencia, 26 (2): 53-61.
Medina, L., Castañeda, J., Fermín, I., Pérez-Castresana, G. & López-Monroy, F. (2013). Variación espacio-temporal del caudal y el transporte de nutrientes en el río Manzanares. Boletín del Instituto Oceanográfico de Venezuela, 52 (2): 67-75.
Mullin, J. & Riley, J. (1955). The spectrophotometric determination of silicate-silicon in natural waters with special reference to sea water. Analytica Chimica Acta, 12, 162-170.
Murphy, J. & Riley, J. (1962). A modified single solution method for the determination of phosphate in natural waters. Analytica Chemical Acta, 12, 162-170. http://dx.doi.org/10.1016/S0003-2670(00)88444-5
Okuda, T., García, A., Gamboa, B. & Fernández, A. (1978). Variación estacional de fósforo y nitrógeno inorgánicos en el Golfo de Cariaco, Venezuela. Bol. Boletín del Instituto Oceanográfico de Venezuela, 17 (1 y 2): 89-104.
Pennino, M. J., Leibowitz, S. G., Compton, J. E., Hill, R. A. & Sabo, R. D. (2020). Patterns and predictions of drinking water nitrate violations across the conterminous United States. Science of The Total Environment, 722, 137661. https://doi: 10.1016/j.scitotenv.2020.137661
Rabalais, N. N. (2002). Nitrogen in aquatic ecosystems. AMBIO: A. Journal of the Human Environment, 31(2), 102–112. https://doi.org/10.1579/0044-7447-31.2.102
Ravi, N.K., Srivastava, A., Ram, K. & Jha, P.K. (2021). Nutrient chemistry and eutrophication risk assessment of the Ghaghara river, India. Water Supply, 21 (7):3486-3502. https://doi.org/10.2166/ws.2021.110
Redfield, A. C., Ketchum, B. H. & Richards, F. A. (1963). The Influence of Organisms on the Composition of Seawater. The sea. Vol. 2 (pp. 26–77). Wiley.
Reynolds, C.S. & Davies, P.S. (2001) Sources and bioavailability of phosphorus fractions in fresh waters: a British perspective. Biological Reviews, 76 (1):27–64. https://doi.org/10.1111/j.1469-185X.2000.tb00058.x
Rivas, Z., Sánchez, J., Troncone, F., Márquez, R., Ledo de Medina, H., Colina, M. & Gutiérrez, E. (2009). Nitrógeno y fósforo totales de los ríos tributarios al sistema lago de Maracaibo, Venezuela. Interciencia, 34(5):308-314.
Rivas, Z., Márquez, R., Troncone, F., Sánchez, J., Colina, M. & Hernández, P. (2005) Contribución de principales ríos tributarios a la contaminación y eutrofización del Lago de Maracaibo. Ciencia, 13: 68-77.
Rivas, Z., Sánchez, J., Troncone, F., Márquez, R., Colina, M. & Ledo de Medina, H. (2006) Evaluación físico química y bacteriológica del agua del río Catatumbo y sus afluentes, estado Zulia-Venezuela. Ciencia, 14(2): 252-262.
Royer, T. V (2020). Stoichiometry of nitrogen, phosphorus, and silica loads in the Mississippi-Atchafalaya River basin reveals spatial and temporal patterns in risk for cyanobacterial blooms. Limnology and Oceanography, 65:325-335. https:// doi.org/ 10. 1002/ lno. 11300.
Ruíz, L., Salazar, S.K., Pérez, J. & Alfonsi, C. (2005). Diversidad íctica del sistema hidrográfico río Manzanares, Estado Sucre, Venezuela. Boletín del Centro de Investigaciones Biológicas. 39 (2): 91-107.
Salazar, S. K., Alfonsi, C., Gómez, B., Bello, J. A., Senior, W. y Troccoli, L. (2018). Estado de conservación del sistema hidrográfico del río Manzanares, región Caribe Oriental de Venezuela. En: Rodríguez-Olarte, D. (Ed). (2018). Ríos en riesgo de Venezuela. Vol. 2. Colección Recursos hidrobiológicos de Venezuela. Universidad Centroccidental Lisandro Alvarado (UCLA). Barquisimeto, Lara. Venezuela.
Savenko, V. S. & Savenko, A. V. (2022). The Main Features of Phosphorus Transport in World Rivers. Water, 14 (16). 1-32. https://doi.org/10.3390/w14010016
Scibona, A., Nizzoli, D., Hupfer, M., Valerio, G., Pilotti, M. & Viaroli, P. (2022). Decoupling of silica, nitrogen and phosphorus cycling in a meromictic subalpine lake (Lake Iseo, Italy). Biogeochemistry. 159, 371–392. https://doi.org/10.1007/s10533-022-00933-9
Seitzinger, S. P., Kroeze, C., Bouwman, A. F., Caraco, N. & Dentener, F. (2002). Styles, Global patterns of dissolved inorganic and particulate nitrogen inputs in coastal ecosystems: recent conditions and future projections. Estuaries, 25, 640–655. https://doi.org/10.1007/bf02804897
Semenov, M. Y.; Silaev, A. V.; Semenov, Y. M. & Begunova, L. A. (2024). Revealing the Sources of Nutrients in the Surface Waters of the Selenga River Watershed Using Hydrochemical and Geospatial Data. Water, 16, 630. https:// doi.org/10.3390/w1605063
Senior, W, Castañeda, J. & Martínez, G. (1998). Problemática ambiental del río Manzanares y la zona costera de Cumaná. https://doi.org/10.31219/osf.io/b3cc2
Senior, W., & Godoy, G. (1991). Estudio fisicoquímico del río Manzanares, Cumaná, Venezuela. Boletín del Instituto Oceanográfico de Venezuela, 29 (1 y 2):160-172.
Serediak, N. A., Prepas, E. E. & Putz, G. J. (2014). Eutrophication of freshwater systems. In: Holland HD, Turekian KK (Eds). Treatise on geochemistry (pp 305–32). Elsevier, Oxford. https://doi.org/10.1016/B978-0-08-095975-7.00908-6
Strickland, J. & Parsons, P. (1972). A practical Handbook of seawaters Analysis, 2Edition. Bulletin - Fisheries Research Board of Canada. Canada.
Tesoriero, A. J.,·Robertson, D. M., Green, C. T.,·Böhlke, J. K., Harvey, J.W. &. Qi, S. L. (2024). Prioritizing river basins for nutrient studies. Environmental Monitoring and Assessment, 196: 248.: 1-21. https://doi.org/10.1007/s10661-023-12266-7
Thompson, R. L., Lassaletta, L., Patra, P. K., Wilson, C., Wells, K. C., Gressent, A., Koffi, E. N., Chipperfield, M. P., Winiwarter, W., Davidson, E. A., Tian, H. & Canadell, J. G. (2019). Acceleration of global N2O emissions seen from two decades of atmospheric inversion. Nature Climate Change, 9, 993–998. https://doi.org/10.1038/s41558-019-0613-7
Tivig, M, Keller, D. P. & Oschlies, A. (2024). Riverine nutrient impact on global ocean nitrogen cycle feedbacks and marine primary production in an Earth System Model.Egusphere. https://doi.org/10.5194/egusphere-2024-258
Tokareva, I. V. & Prokushkin, A. S. (2022). Seasonal and Spatial Variability of Dissolved Nutrients in the Yenisei River. Water, 14, 3935. https:// doi.org/10.3390/w14233935
Treguer, P. & Le Corre, P. (1975). Manual d’analyses des sels nutritifs dans l’eau demer. Utilization de l’Auto-Analyzer II. Techicon. LOC-UBO (2Eds). Paris, France.
Turner, R. E., Rabalais, N. N., Justic, D. & Dortch, Q. (2003). Global patterns of dissolve N, P and Si in large rivers. Biogeochemistry, 64, 297–313. http://www.jstor.org/stable/1469745
Valderrama, J. 1981. The simultaneous analysis of total nitrogen and total phosphorus in natural waters. Marine Chemical, 10: 109-122. http://dx.doi.org/10.1016/0304-4203(81)90027-X
Ward, M. H., Jones, R. R., Brender, J. D., De Kok, T. M., Weyer, P. J., Nolan, B. T., Villanueva, C. M., & Van Breda, S. G. (2018). Drinking water nitrate and human health: an updated review. International Journal of Environmental Research and Public Health, 15, 1557. https:// doi.org/10.3390/ijerph15071557
Weiss, R. (1970). The solubility of nitrogen, oxygen and argon in water and seawater. Deep Sea Research, 17, 721–735. https://doi.org/10.1016/0011-7471(70)90037-9
Yu, J.; Mo, L.; Dai, J.; Bai, K.; Mo, J. & Zhang, S. (2024). Nitrogen and Phosphorus Pollution Discharge and Water Quality Evaluation in a Small Basin of the Upper Reaches of Lijiang River. Water, 16, 104. https:// doi.org/10.3390/w16010104
BIODATA
Aristides Márquez: Licenciado en química, MSc. Oceanografía Química; Dr. En Ciencias Marinas. Investigador y Profesor de Postgrado en Ciencias Marinas. Jefe de los laboratorios de biogeoquímica, elementos nutritivos y de metales pesados en ecosistemas marinos, costeros y fluviales. Universidad de Oriente, Instituto Oceanográfico de Venezuela. Dep. de Oceanografía. Publicaciones: Biodiversidade Brasileira, 12(2): 1-10, (2022). Foro Iberoam. Rec. Mar. Acui. 11: 162-177 (2023). Foro Iberoam. Rec. Mar. Acui. 11:142-154 (2023). Acta Oceanográfica del Pacífico. 6(1). 65-81 (2024). Bol. Inst. Oceanogr. Venez. 63 (01): 01-20 (2024). Boletín Instituto del Mar Perú. 39 (2): 64-82. (2024). Foro Iberoam. Rec. Mar. Acui. 12: 485-507 (2024).
Andreina Lemus: Ingeniera en procesos químicos Magíster en Ciencias Marinas Investigadora en IOV. Universidad de Oriente, Instituto Oceanográfico de Venezuela. Departamento. de Oceanografía.