
EVALUACIÓN DEL EFECTO DE Gloeocapsopsis crepidinum (THURET) SOBRE EL CRECIMIENTO DE Salmonella sp., Escherichia coli Y Fusarium oxysporum
Effect of Gloeocapsopsis crepidinum (Thuret) on the growth of Salmonella sp., Escherichia coli and Fusarium oxysporum
RESUMEN
Las cianobacterias, son microorganismos fotosintéticos con un gran potencial biotecnológico debido a la producción de diversos compuestos bioactivos con propiedades antimicrobianas, antivirales, antifúngicas y anticancerígenas. En este estudio, se evaluó el potencial antimicrobiano de cianobacterias colectadas en el lago de Camécuaro, Michoacán, México. El aislamiento se realizó por la técnica de diluciones seriadas y se obtuvieron cultivos monoalgales, cuyas condiciones de crecimiento fueron: temperatura ambiente, agitación a 102 rpm e intensidad de luz blanca de 14,86 a 21,62 µmol m-2 s-1. Para la identificación morfológica se utilizaron claves dicotómicas y para la identificación molecular se amplificó una región del gen que codifica para el rARN 16S y se analizó su secuencia in silico. La cianobacteria fue identificada como Gloeocapsopsis crepidinum (Thuret) Geitler ex Komárek 1993. Se realizaron cultivos puros y se obtuvieron extractos metanólicos de los metabolitos extracelulares, con los cuales se evaluó su actividad antimicrobiana contra Escherichia coli PL20, Salmonella sp. y Fusarium oxysporum. Los extractos mostraron un efecto antimicrobiano estadísticamente significativo sobre E. coli, pero no sobre Salmonella sp. ni sobre F. oxysporum.
Palabras clave: cianobacteria; identificación morfológica; identificación molecular; actividad antimicrobiana; compuestos bioactivos; antifúngico.
ABSTRACT
Cyanobacteria are photosynthetic microorganisms with significant biotechnological potential, given their capacity to produce a diverse array of bioactive compounds with antimicrobial, antiviral, antifungal, and anticancer properties. The present study evaluated the antimicrobial potential of cyanobacteria collected from Lake Camécuaro, Michoacán, Mexico. Isolation was performed by the serial dilution technique, and monoalgal cultures were obtained under the following conditions: room temperature, agitation at 102 rpm, and white light intensity ranging from 14,86 to 21,62 µmol m-2 s-1. For morphological identification, dichotomous keys were employed, while for molecular identification, a region of the gene coding for 16S rRNA was amplified and its sequence analyzed in silico. The cyanobacterium was identified as Gloeocapsopsis crepidinum (Thuret) Geitler ex Komárek 1993. Pure cultures were cultivated and methanolic extracts of the extracellular metabolites were obtained and evaluated for their antimicrobial activity against Escherichia coli PL20, Salmonella sp. and Fusarium oxysporum. The extracts demonstrated a statistically significant antimicrobial effect on E. coli, but not on Salmonella sp. or F. oxysporum.
Keywords: cyanobacteria; morphologic identification; molecular identification; antimicrobial activity; bioactive compounds; antifungal activity.
INTRODUCCIÓN
México cuenta con una gran riqueza de microalgas y cianobacterias, debido, principalmente, a su clima y geografía. Sin embargo, se tiene escasa información sobre su biodiversidad y potencial biotecnológico, especialmente en la zona del Bajío Mexicano. Por su relevancia ecológica y capacidades metabólicas, es fundamental generar más conocimiento de las microalgas y cianobacterias, ya que pueden tener aplicaciones en diversas áreas como la biotecnología, industria alimentaria, farmacéutica, agrícola y eléctrica (Lozano-García et al., 2019; Pérez-Bravo et al., 2019; Sosa-Hernández et al., 2019).
Las cianobacterias son microorganismos procariotas fotosintéticos Gram (-), por lo que se encuentran en el domino Bacteria (Llopiz, 2016). Producen clorofila a y ficobilinas como pigmentos y presentan características fotosintéticas semejantes a las plantas y algas eucariotas (Kumar et al., 2019). Las cianobacterias son conocidas por sus aplicaciones potenciales en biotecnología, entre los que se encuentran compuestos bioactivos con actividad antimicrobiana (Martínez Guillén, 2012). Las cianobacterias se clasifican en cinco órdenes, los órdenes Chroococcales y Pleurocapsales, que incluyen especies unicelulares y coloniales, que se reproducen por fisión binaria o por división múltiple respectivamente. Un tercer orden corresponde a las Chroococcidiopsidales conformado por células cocales que se caracteriza por ser extremófilas y crecer en condiciones de alta radiación UV, alta y baja temperatura, alta desecación y salinidad; cabe mencionar que anteriormente los organismos de este orden se les clasificaba dentro del orden Pleurocapsales debido a su patrón de crecimiento; sin embargo, las Chroococcidiopsidales no presentan beocitos o baeocitos, (células especializadas donde se efectúa la fisión múltiple) y con base en los análisis moleculares de su genoma se sugiere que son más cercanas filogenéticamente a las cianobacterias con heterocistos (Nostocales). El cuarto orden corresponde a las Oscillatoriales, que agrupa a las cianobacterias, tienen forma de tricomas o de filamentos. Finalmente, los órdenes Nostocales y Stigonematales incluyen cianobacterias filamentosas que son capaces de presentar una diferenciación celular; sin embargo, las Nostocales muestran verdadera ramificación y división en más de un plano, mientras que Stigonematales presenta falsas ramificaciones que, sin embargo, puede llegar a formar pseudoparénquimas (Baldanta, 2022; Komárek 2016, Novelo, 2011; Waterbury, 2006; Komárek y Anagnostidis, 1999).
En investigaciones recientes se ha podido apreciar el potencial enorme de las cianobacterias en muchos campos, como una fuente potencial de compuestos para biocombustibles y biofertilizantes, así como para biorremediación (Llopiz, 2016; Zahra, et al. 2020). Además, a pesar de que estos microorganismos son ampliamente conocidos por los compuestos tóxicos que producen y por el daño que ocasionan al ambiente y al ser humano cuando están implicados en floraciones donde tienen un crecimiento descontrolado (Du, et al. 2019), también se ha estudiado su potencial para el tratamiento de algunos tipos de cáncer, además de los compuestos bioactivos con actividad antiviral, antifúngica y antimicrobiana que poseen, por su amplio potencial biotecnológico (Zahra, et al. 2020; Carpine y Sieber, 2021; Singh, et al. 2023).
Esta investigación explora el potencial de un aislado identificado como Gloeocapsopsis crepidinum (Thuret) Geitler ex Komárek 1993, cianobacteria que se ha reportado produce metabolitos con efectos antimicrobianos (Martínez Guillén, 2012), información que puede ser útil para el desarrollo de nuevos medicamentos que ayuden a evitar la resistencia de los microorganismos responsables de las enfermedades actuales o futuras, siendo una potencial contribución para lograr el objetivo “Salud y bienestar” de la Agenda 2030 de la ONU (2018), así como también establecer las bases para el diseño de estrategias para el aprovechamiento de estos organismos.
MATERIALES Y MÉTODOS
Recolección y aislamiento de la muestra
La muestra de agua fue recolectada directamente del lago de Camécuaro a nivel de superficie, Michoacán, México (19°54’27,3” N/ 102°12’39,5” W). El pH del sitio de colecta fue de 8,2, la temperatura 19,6 °C y el oxígeno disuelto 2,0 ppm (Cano y Mendoza, 2019). Para su conservación, 50 mL de las muestras fueron cultivadas en 250 mL de medio basal de Bold (BBM) adicionando con una solución de vitaminas: B1 (tiamina HCl) (0,1 g ∙ 100 mL-1), (biotina 0,025 mg ∙ 100 mL-1) y vitamina B12 (cianocobalamina) (0,015 mg ∙ 100 mL-1) (Andersen, 2005). Para el aislamiento, se realizó la técnica de diluciones seriadas decimales añadiendo 4,5 mL del medio BBM con vitaminas y 0,5 mL de inóculo a tubos de ensayo; se dejaron en agitación a 102 rpm, temperatura ambiente y con luz blanca a 14,86 a 21,62 µmol m-2 s-1. También se inocularon una serie de placas de Petri con medio BBM sólido vitaminado, con la técnica de barrido en placa. De la dilución seleccionada se tomaron inóculos para los siguientes procedimientos.
Identificación morfológica y molecular
Para la identificación morfológica a nivel de género del aislado, se realizó la observación de tres preparaciones semipermanentes de la muestra de agua, de acuerdo con lo descrito por González-González y Novelo (1986). Se visualizaron las laminillas en un microscopio compuesto Iroscope, (100240V-50/60HZ), utilizando el lente de 100x. Para la determinación de la especie se utilizaron las claves de Komárek y Anagnostidis (1999). Además, se tomaron fotografías con una cámara Nikon modelo Coolpix con 20,1 megapixels. Para la identificación molecular se realizó la extracción de ADN de la muestra, donde se utilizó el kit de mini preparación DNA (Zymo Research) siguiendo las instrucciones del fabricante. Para la amplificación del gen rRNA 16S, se realizó la técnica de PCR con la mezcla de reacción DreamTaq super mix (Thermo Scientific) con los oligos F27 (AGA GTT TGAT CCT GGC TCAG) y R1492 (GGT TAC CTT GTT ACG ACTT), con el siguiente programa: un ciclo 95 °C, cinco min: 25 ciclos, 94 ºC un min, 55 ºC 50 s, 72 ºC dos min, y un ciclo final de extensión de diez min a 72 ºC. Los productos de la reacción de PCR fueron separados en un gel de agarosa al uno por ciento y visualizados en una foto documentador imager (Thermo Scientific). Los productos del PCR fueron secuenciados en el Laboratorio Nacional de Genómica para la Biodiversidad (LANGEBIO), Cinvestav, Irapuato, Gto. y posteriormente, la secuencia del amplicón se analizó utilizando la herramienta bioinformática Nucleotide BLAST (Basic Local Alignment Search Tool).
Condiciones de crecimiento y determinación de la concentración celular
Se inocularon 50 mL de la cepa de la cianobacteria Gloeocapsopsis crepidinum, identificada con el código [G. crepidinum-2004], en 150 mL de medio BBM, se dejó crecer 18 días a 25 °C, con agitación de 102 rpm e intensidad luminosa de 14,86 a 21,62 µmol m-2 s-1por 24 h. Se realizó un conteo celular cada tercer día, con la cámara de Neubauer y un microscopio óptico.
Obtención de metabolitos extracelulares
Se prepararon tres matraces con medio BBM y la cepa G. crepidinu-2004 (50 mL de inóculo de células 107 en 150 mL de BBM vitaminado). Se prepararon tres tubos Falcón (previamente pesados) para cada ensayo donde se agregaron 10 mL de cultivo al final de la fase estacionaria (106 a 107 células mL-1). Posteriormente, se centrifugaron a 4.500 rpm durante 20 min., se desechó el sobrenadante y se pesó el tubo con el precipitado para obtener aproximadamente 30 mg de biomasa (peso húmedo). Posteriormente, se añadieron tres mL de metanol al tubo con biomasa, se agitó en un vortex por 10 segundos y finalmente se dejó incubando a temperatura ambiente por 10 min. A continuación, se centrifugó a 4.500 rpm por seis min., el sobrenadante se transfirió a un nuevo tubo de ensaye y se dejó evaporar el metanol a temperatura ambiente en una campana de extracción. Por último, el extracto seco se resuspendió en un mL de metanol (Torres-Ariño, 2004).
Antibiogramas
Los microorganismos Salmonella sp., y Escherichia coli PL20 fueron cultivados en medio Caldo Luria Bertani (LB) y Fusarium oxysporum (ATCC - 60095) en Caldo Dextrosa Sabouraud (CDS); las bacterias se incubaron a 36 °C y el hongo filamentoso a 28 °C. Los sensidiscos se prepararon con papel filtro con un diámetro de seis mm, se esterilizaron y se les agregó 30 μL de extracto extracelular de la cianobacteria y para el control se añadió 30 μL metanol en el sensidisco. Se prepararon placas de Agar Salmonella y Shigella (SS) para bacterias y Agar Dextrosa y Papa para hongos; posteriormente se inocularon y dispersaron 100 μL del cultivo de Salmonella y E. coli, cada una en tres placas de medio LB y 100 μL de F. oxisporum en tres placas de PDA. Las placas de incubaron a temperatura ambiente por 30 min., posteriormente se colocaron los sensidiscos por triplicado de cada ensayo y un sensidisco como control negativo con metanol, se incubaron por 24 h, y se midió el halo de inhibición.
Análisis estadístico
Para el análisis de los resultados del halo de inhibición, se empleó el programa GraphPad, Prism versión 9.4.1 (458); GraphPad software, LLC.
RESULTADOS Y DISCUSIÓN
Aislamiento e identificación morfológica y molecular de la cianobacteria
La identificación de Gloeocapsopsis crepidinum, fue llevada a cabo por el método de pruebas dicotómicas. Para el aislamiento se utilizó la técnica de diluciones seriadas decimales y usando el medio BBM. En la realización de las diluciones seriadas se utilizó la dilución 1:4, es decir, la dilución 10-4, debido a que en esta dilución se apreciaba la presencia de una sola morfología celular, considerándose hasta este punto, como cultivo unialgal.
En el análisis de morfología se determinó que estas células pertenecían al orden Chroococcales debido a la colonia, la forma y la polaridad de las células y a la disposición en pares de las células, así como también, estas estructuras evidenciaron una división celular por fisión binaria, propio de este orden (Waterbury, 2006; Novelo, 2011; Baldanta, 2022). Además, cabe mencionar que la morfología celular observada correspondía con miembros de la familia Chroococcaceae cuyas células en su mayoría son subesféricas sin ser esféricas u ovaladas, con cierta irregularidad producto de su división en varios planos (Komárek y Anagnostidis, 1999; Novelo, 2011; Guiry y Guiry 2023). Finalmente, pudo determinarse que las células analizadas pertenecían a células de Gloeocapsopsis crepidinum, ya que éstas se caracterizan por estar rodeadas por vainas delgadas, firmes y estrechas, lo cual se observó en la cepa aislada (Figura 1A), además de observarse características propias de esta especie, tales como: colonias macro o microscópicas irregulares, las cuales pueden ser granulares, compuestas de células densamente agregadas irregularmente y formar grandes masas, aunque puede encontrarse formando pequeños grupos rodeadas de envolturas mucilaginosas, en forma de paquete (rara vez solitarias), así como también, la formación de una masa gelatinosa plana o granular macroscópica, subesférica o irregularmente redondeada en contorno, a veces ligeramente alargada, de 20 micras de diámetro, generalmente con envolturas gelatinosas individuales. Las subcolonias de G. crepidinum se caracterizan por estar conformadas por dos células o más, protegidas por una o más capas mucilaginosas bien delimitadas, amarillentas o transparentes y no están lameladas. Las células son generalmente hemisféricas a ovaladas que miden hasta 4,5 micras de largo y 3,8 de ancho. El contenido celular es de color verde azulado pálido o brillante, sin vesículas de gas evidentes. Para la determinación de la especie, se siguieron los criterios de Komárek y Johansen (2015) y para la posición sistemática (Figura 1B), se siguió lo establecido por Guiry y Guiry (2023).
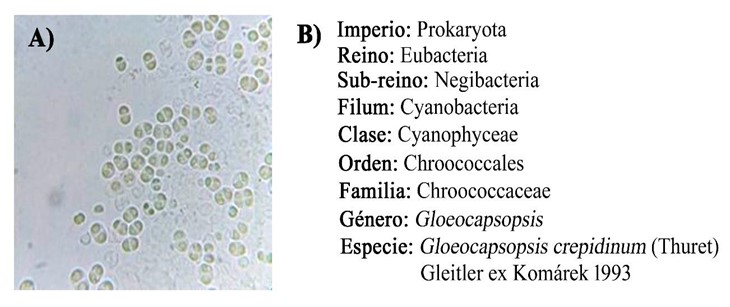
Figura 1. Morfología celular de Gloeocapsopsis crepidinum 100x (A) y su posición sistemática (B) fue obtenida siguiendo lo establecido por Guiry y Guiry (2023).
En el análisis de identificación molecular, las secuencias obtenidas del gen del RNA ribosomal 16S, amplificadas por PCR, a partir del DNA de Gloeocapsopsis crepidinum, se sometieron,a un análisis con la herramienta “Nucleotide BLAST” para determinar por similitud de secuencias, el organismo al que pertenecen. Como resultado del análisis, la secuencia obtenida en este estudio tuvo un 99,5 7% de identidad con Gloeocapsopsis sp. LEGE 13420, lo que confirmó la identificación morfológica previamente descrita. La secuencia fue registrada en GenBank, se le asignó el número de acceso OR251063.1. De este modo, se confirmó el género de la cianobacteria usando las secuencias de las regiones hipervariables del gen rARN 16S, las cuales se emplean como marcadores moleculares debido a que cada organismo tiene secuencias específicas diferentes que los diferencian de otros organismos. Esto se debe a que el gen rARN 16S codifica a uno de los ARN ribosomales que forman parte de la estructura de los ribosomas, que se encargan de la síntesis de proteínas y como las células de todos los organismos vivos dependen de esta síntesis, los ribosomas son esenciales para todos los organismos. Es por ello que, al compararse las secuencias de estos genes, se puede tener una correlación entre las diferencias de las secuencias y los grupos de organismos analizados o, dicho de otro modo, se pueden agrupar a los organismos por las similitudes de las secuencias de estos genes.
No obstante, pese a que la secuencia encontrada fue de Gloeocapsopsis sp., en el análisis de morfología, también fueron encontradas otras células en menor proporción. Dentro de otras cianobacterias encontradas están: Aphanocapsa y Chroococcus. En este punto, cabe mencionar que en la identificación molecular no se encontraron secuencias pertenecientes a las otras células, lo que confirma que están en muy baja proporción como para encontrarse material genético suficiente y que Gloeocapsopsis crepidinum está en una proporción tal, que puede considerarse como un cultivo puro, para los ensayos realizados.
Determinación de la concentración celular
Se determinó la curva de crecimiento celular del aislado bajo las condiciones experimentales descritas. Se logró establecer que su fase estacionaria inició después de los 15 días, con una concentración celular máxima de 1,76 x 107 células mL-1 (Figura 2).
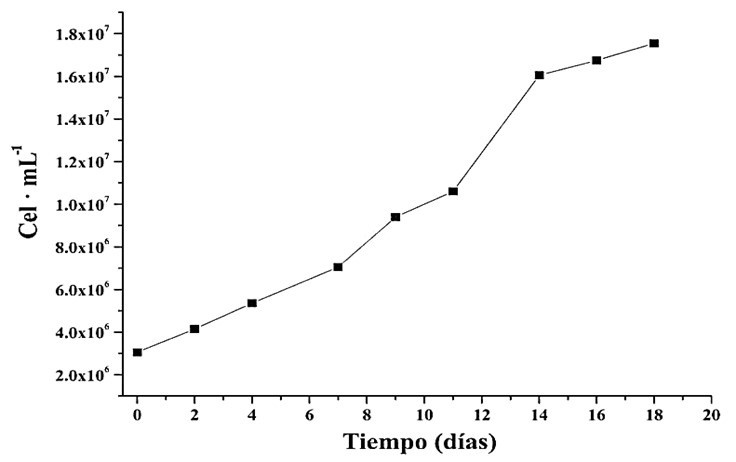
Figura 2. Curva de crecimiento de Gloeocapsopsis crepidinum, en medio BBM, a 25 °C, con una agitación a 102 rpm e intensidad luminosa de 14,86 a 21,62 µmol m-2 s-1 durante 24 h, por 18 días.
Determinación de la actividad antimicrobiana/antifúngica de los extractos de Gloeocapsopsis crepidinum (Thuret) Geitler ex Komárek 1993
Para determinar el efecto antimicrobiano y antifúngico de los metabolitos producidos por la cianobacteria, se realizaron antibiogramas en donde se evaluó el efecto del extracto de G. crepidinum sobre el crecimiento de E. coli PL20, Salmonella sp. y sobre Fusarium oxysporum. En cada placa se agregaron tres sensidiscos con 30 µL de extracto metanólico de la cianobacteria (tres réplicas) y un cuarto sensidisco con el metanol con el que se realizó el extracto de la C. crepidinum como control negativo. Se realizaron tres repeticiones. Posteriormente se midieron los halos de inhibición de los tratamientos y se les dieron tratamiento estadístico a los datos obtenidos para conocer si el efecto era estadísticamente significativo.
En el tratamiento con el extracto metanólico de G. crepidinum sobre el crecimiento de Salmonella sp. y F. oxysporum ATCC 60095 no tuvo un efecto significativo, ya que, aunque si se presentaron halos de inhibición en un intervalo de 6,3 a 10 mm, no hubo una diferencia significativa con el control, ya que algunas repeticiones este último presentó un halo de inhibición (Tabla 1).
Tabla 1. Efecto antimicrobiano de los extractos metanólicos de Gloeocapsopsis crespidinium (Thuret) Geitler ex Komárek 1993, sobre los microorganismos probados.
|
Muestra |
Diámetro del halo de inhibición (mm) |
||||
|
R1 |
R2 |
R3 |
Promedio |
||
|
E. coli PL20 |
Control |
9,05 |
8,75 |
7,66 |
8,48 ± 0,73 |
|
Réplica 1 |
13,19 |
12,73 |
14,24 |
13,92 ± 0,55 |
|
|
Réplica 2 |
13,71 |
13,44 |
14,99 |
||
|
Réplica 3 |
13,47 |
14,49 |
15,05 |
||
|
Salmonella sp. |
Control |
10,18 |
10,17 |
9,23 |
9,86 ± 0,55 |
|
Réplica 1 |
9,03 |
8,52 |
8,67 |
8,66 ± 0,16 |
|
|
Réplica 2 |
8,71 |
8,62 |
8,67 |
||
|
Réplica 3 |
8,53 |
8,72 |
8,51 |
||
|
F. oxysporum |
Control |
6,22 |
6,39 |
6,98 |
6,53 ± 0,40 |
|
Réplica 1 |
8,91 |
9,60 |
8,49 |
8,76 ± 0,49 |
|
|
Réplica 2 |
9,25 |
8,05 |
9,04 |
||
|
Réplica 3 |
8,69 |
8,55 |
8,27 |
||
R1: Primera repetición biológica. R2: Segunda repetición biológica. R3: Tercera repetición biológica. Control: Metanol. Cada réplica contenía 30 µL de extracto metanólico de la Gloeocapsopsis crepidinum (Thuret) Geitler ex Komárek 1993.
El hecho de que el metanol por sí solo tenga un efecto inhibitorio se debe principalmente a que el metanol como alcohol de bajo peso molecular, al ser un surfactante natural, afecta a las membranas celulares inhibiendo la absorción de grupos hidrofóbicos, y, por lo tanto, afectando la integridad de las membranas, así como su funcionamiento normal en la absorción de nutrientes, inhibiendo el crecimiento bacteriano (Rivera y Lima, 2013). No obstante, sí pudo apreciarse un efecto del extracto de esta cianobacteria sobre crecimiento de E. coli PL20, ya que los halos de inhibición presentados tuvieron de 10 a 15 mm de diámetro, mayor que en el control, teniendo una diferencia estadísticamente significativa (Figura 3).
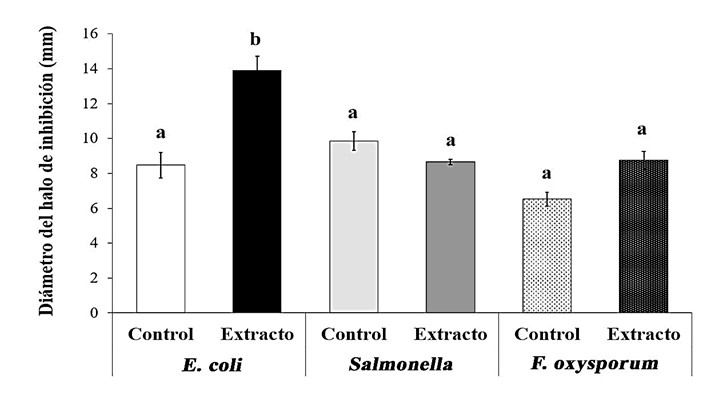
Figura 3. Efecto del extracto metanólico de Gloeocapsopsis crepidinum sobre el crecimiento de E. coli, Salmonella sp. y Fusarium oxysporum. Media ± SD, n = 9. Las letras indican la diferencia estadística según la prueba de ANOVA de una vía, Prueba Post hoc de Tukey, P < 0,0001. Datos provenientes de tres experimentos independientes.
En este trabajo se empleó metanol para la extracción de metabolitos con propiedades antimicrobianas, ya que es uno de los más utilizados para la extracción de metabolitos secundarios de cianobacterias, además del hexano y diclorometano, de acuerdo con los estudios de Vega López (2016), en donde se usaron solventes de hexano, acetato de etilo, diclorometano, tetrahidrofurano y metanol para la extracción de los metabolitos de Arthrospira máxima , o bien, usando diclorometano, metanol y la mezcla de estos para la obtención de extractos orgánicos de cinco cianobacteria (Torres-Ariño, 2004). También, se ha reportado que los extractos metanólicos y etanólicos de varias especies de cianobacterias de distintos hábitats poseen propiedades antioxidantes con potencial biotecnológico, debido principalmente, a los compuestos fenólicos y flavonoides presentes en dichos extractos, entre los que se han reportado los ácidos: gálico, siríngico, protocatecúico y clorogénico, así como los flavonoides: catequina y epicatequina. Además, se he descrito que metanol es más efectivo en la extracción de este tipo de compuestos antioxidantes (Jerez-Martel et al, 2017; Guerreiro et al., 2020). Por lo que es muy probable que el efecto mostrado en el crecimiento de E. coli se deba principalmente a los flavonoides y compuestos fenólicos presentes en el extracto metanólico de G. crepidinum.
Por otra parte, dentro de los compuestos antimicrobianos que presentan algunas cianobacterias se encuentran: policétidos tales como: los alquilresorcinoles, la nostociclina A, la cilindrofridina A, los carbarbamidociclofanos y los cilondrociclofanos; así como también péptidos, en dos grandes grupos: sintetizados directamente por los ribosomas y aquellos que necesitan modificaciones postraduccionales). En un tercer grupo están los alcaloides, representados por los compuestos tipo hapalindol con más de 80 miembros. El siguiente grupo están los compuestos tepenoides, dentro de los que se encuentran el diterpenoide noscomina, el scytoscalarol, y las cibastacinas A y B. Algunos lípidos forman el cuarto grupo de compuestos antimicrobianos. En el siguiente grupo están los lipopéptidos entre los que se encuentran las malingamidas, las grenadamidas y la galinamida A, entre otros; y finalmente a los polifenoles como último grupo, cuyos mayores exponentes son los ambigoles clorados A, B y C y los crossbianoles polibromados A, B, C y D (revisado ampliamente por Carpine y Sieber, 2021 y Cock y Cheesman, 2023). Por lo anterior, es muy probable que el efecto de Gloeocapsopsis crepidinum sobre E. coli se deba principalmente a compuestos polifenólicos que se caracterizan por ser extraídos en soluciones alcohólicas, así como también, alcaloides que pueden ser extraídos bajo estas condiciones. Estos dos grupos de compuestos constituyen la mitad de todos los compuestos antimicrobianos reportados, teniendo los alcaloides un 43 % (Carpine y Sieber, 2021).
CONCLUSIONES
Se logró aislar e identificar como Gloeocapsopsis crepidinum (Thuret) Geitler ex Komárek 1993 a nivel morfológico y molecular una de las cianobacterias que se encuentra presente en el lago de Camécuaro, Michoacán, México. Además, se observó que los extractos metanólicos de esta cianobacteria tienen un efecto inhibitorio sobre el crecimiento de E. coli PL20, revelando la presencia de metabolitos antimicrobianos que probablemente, por la naturaleza del extracto, pueden tratarse de flavonoides y compuestos fenólicos, sin embargo, este extracto no tuvo efecto sobre el crecimiento de Samonella sp. ni de Fusarium oxysporum ATCC-60095 bajo las condiciones experimentales utilizadas. Por lo tanto, los resultados siguieren que el extracto metanólico de Gloeocapsopsis crepidinum tiene metabolitos con potencial antimicrobiano contra E. coli PL20 más no contra Samonella sp. o Fusarium oxysporum lo que deja la puerta abierta a la caracterización completa de este extracto, así como su efecto sobre otros sistemas.
AGRADECIMIENTOS
Este trabajo forma parte del proyecto: Construcción de un prototipo - soporte para conservación de un banco de microalgas y cianobacterias con potencial biotecnológico aisladas de cuerpos de agua del Bajío Mexicano y creación de un sitio Web para su difusión, del laboratorio de Metabolitos Biofuncionales del ITESI, responsable del proyecto LVS.
LITERATURA CITADA
Andersen, R.A. (2005). Algal culturing techniques. Elsevier Academic Press.
Baldanta Callejo, S. (2022). Desarrollo de herramientas biotecnológicas en cianobacterias. [Tesis de doctorado, Universidad complutense de Madrid]. Repositorio institucional de la Universidad Complutense de Madrid. https://eprints.ucm.es/id/eprint/77808/
Cano, I. & Mendoza, T. Bioprospección de microalgas nativas de la cordillera Neovolcánica. [Tesis inédita]. Instituto Tecnológico Superior de Irapuato.
Carpine, R. & Sieber, S. (2021). Antibacterial and antiviral metabolites from cyanobacteria: Their application and their impact on human health. Current Research in Biotechnology, 3, 65-81. https://doi.org/10.1016/j.crbiot.2021.03.001
Cock, I.E. & Cheesman, M.J. (2023). A Review of the Antimicrobial Properties of Cyanobacterial Natural Products. Molecules, 28, 7127. https://doi.org/10.3390/molecules28207127
Du, X., Liu, H., Yuan, L., Wang, Y., Ma, Y., Wang, R., Chen, X., Losiewicz, M.D., Guo, H. & Zhang, H. (2019). The Diversity of Cyanobacterial Toxins on Structural Characterization, Distribution and Identification: A Systematic Review. Toxins, 11, 530. https://doi.org/10.3390/toxins11090530
González-González, J. &Novelo, E. (1986). Algas. En Lot, A. & Chiang, F. Manual de Herbario. Administración y manejo de colecciones, técnicas de recolección y preparación de ejemplares botánicos (pp. 47–54). México D.F.: Consejo Nacional de Flora de México. https://doi.org/10.13140/2.1.1888.2884
GraphPad software, LLC. (2022). GraphPad, Prism versión 9.4.1 (458).
Guerreiro, A., Andrade, M.A., Menezes, C., Vilarinho, F. & Dias, E. (2020). Antioxidant and Cytoprotective Properties of Cyanobacteria: Potential for Biotechnological Applications. Toxins, 12, 548. https://doi.org/10.3390/toxins12090548
Guiry, M. D. & Giury, G. M. (2023). AlgaeBase. World-wide electronic publication, University of Irelanda Galway. Recuperado de http://www.algaebase.org
Jerez-Martel, I., García-Poza, S., Rodríguez-Martel, G., Rico, M., Afonso-Olivares, C. & Gómez-Pinchetti, J. L., (2017). Phenolic Profile and Antioxidant Activity of Crude Extracts from Microalgae and Cyanobacteria Strains, Journal of Food Quality, 2924508, 8 2017. https://doi.org/10.1155/2017/2924508
Komárek, J. & Anagnostidis, K. (1999). Cyanoprokaryota. 1. Chroococcales. En: Ettl, H., Gärtner, G., Heynig, H. & Mollenhauer, D. (Eds.), Süßwasserflora von Mitteleuropa. Begründet von A. Pascher. Band 19/1., pp. 548. Heidelberg & Berlin: Spektrum, Akademischer Verlag.
Komárek, J. & Johansen, R. J. (2015). Chapter 3 - Coccoid Cyanobacteria. En: John D. Wehr, Robert G. Sheath, J. Patrick Kociolek (Eds.), In Aquatic Ecology, Freshwater Algae of North America (2°, ed.). Academic Press.
Komárek, J. 2016. Review of the cyanobacterial genera implying planktic specie after recent taxonomic revision according to polyphasic methods: state as of 2014. Hydobiologia. 764: 259-270.
Kumar, J., Singh, D., Tyagi, M. B. & Kumar, A. (2019). Cyanobacteria: Applications in Biotechnology. En A.K. Mishra, D.N. Tiwari, A.N. Rai (Ed.), Cyanobacteria (pp. 327-346). Academic Press. https://doi.org/10.1016/b978-0-12-814667-5.00016-7
Llopiz, A. (2016). Active compounds from cyanobacteria and microalgae: properties and potential applications in biomedicine. Bionatura, 1(2), 79–88. https://doi.org/10.21931/rb/2016.01.02.8
Lozano-García, D. F., Cuellar-Bermudez, S. P., del Rio-Hinojosa, E., Betancourt, F., Aleman-Nava, G. S. & Parra-Saldivar, R. (2019). Potential land microalgae cultivation in Mexico: From food production to biofuels. Algal Research, 39, 101459. https://doi.org/10.1016/j.algal.2019.101459
Martínez Guillén, J. B. (2012). Bioprospección de la actividad antimicrobiana y biotóxica de extractos de cianobacterias y microalgas [Tesis de maestría, Centro de Investigación Científica y de Educación Superior de Ensenada, Baja California] https://cicese.repositorioinstitucional.mx/jspui/bitstream/1007/610/1/189741.pdf
Novelo, E. (2011). Cyanoprokariota J. Komárek. Flora del Valle de Tehuacán-Cuicatlán (1°, ed.). México, D.F: Instituto de Biología, Universidad Nacional Autónoma de México. 103 pp.
ONU- Organización de las Naciones Unidas. (2018). La Agenda 2030 y los Objetivos de Desarrollo Sostenible: una oportunidad para América Latina y el Caribe (LC/G. 2681-P/Rev. 3), Santiago.
Pérez-Bravo, S. G., Mendoza-Martínez, A. M., Castañeda-Chávez, M. del R. & Aguilera-Vázquez, L. (2019). Bioenergía a partir de microalgas en México. Revista de Energías Renovables, 3(8), 23–34. https://doi.org/10.35429/jre.2019.8.3.23.34
Rivera, J. L. & Lima, E. (2013). Efecto desorbedor del metanol en la membrana celular. TIP Revista Especializada en Ciencias Químico-Biológicas, 16(2), 93-97. Recuperado en 11 de junio de 2024, de http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-888X2013000200002&lng=es&tlng=es
Singh, U., Gandhi, H.A., Nikita, Bhattacharya, J., Tandon, R., Tiwari, G. L. & Tandon, R. (2023). Cyanometabolites: molecules with immense antiviral potential. Arch Microbiol. 205, 164. https://doi.org/10.1007/s00203-023-03514-y
Sosa-Hernández, J., Romero-Castillo, K., Parra-Arroyo, L., Aguilar-Isaías, M., García-Reyes, I., Ahmed, I., Parra-Saldivar, R., Bilal, M. & Iqbal, H. (2019). Mexican Microalgae Biodiversity and State-Of-The-Art Extraction Strategies to Meet Sustainable Circular Economy Challenges: High-Value Compounds and Their Applied Perspectives. Marine Drugs, 17(3), 174. https://doi.org/10.3390/md17030174
Torres-Ariño, A. (2004). Uso de cianobacterias en la producción de antibióticos. Ciencia y Mar. VIII (23): 43-52. http://cienciaymar.mx/Revista/index.php/cienciaymar/issue/view/44/ART23_4
Vega López, J. M. (2016). Aislamiento e identificación de un compuesto con actividad antimicrobiana obtenido de Arthrospira máxima [Tesis de maestría, Instituto Politécnico Nacional, Ciudad de México] https://tesis.ipn.mx/bitstream/handle/123456789/28428/JUAN%20MANUEL%20VEGA%20L%C3%93PEZ.pdf?sequence=1&isAllowed=y
Waterbury, J.B. (2006). The Cyanobacteria—Isolation, Purification and Identification. En M., Dworkin, S. Falkow, E. Rosenberg, KH. Schleifer, y E. Stackebrandt (Eds.) The Prokaryotes (1053-1073). New York: Springer. https://doi.org/10.1007/0-387-30744-3_38
Zahra, Z., Choo, D.H., Lee, H. & Parveen, A. (2020). Cyanobacteria: Review of Current Potentials and Applications. Environments, 7, 13. https://doi.org/10.3390/environments7020013
BIODATA
María Lorena Salas-Mendoza: Ingeniería Bioquímica del Instituto Tecnológico Superior de Irapuato, Guanajuato, México. Participó en el Proyecto de análisis de la Asociación del Microbiota y su relación con enfermedades metabólicas y psicopatológicas en estudiantes de la Escuela de Medicina correspondiente al primer semestre del año 2023.
Laura Valdés Santiago: Docente de Ingeniería Bioquímica en el Instituto Tecnológico Superior de Irapuato: Irapuato, Guanajuato. Ingeniería genética MX. CINVESTAV Irapuato, Gto. México: Irapuato, MX. Hidrobiológica.
Alberto Ayala-Islas: Docente Titular en Ingeniería Bioquímica. Instituto Tecnológico Superior de Irapuato: Irapuato. Publicaciones recientes: Estudio de la cinética de crecimiento de Phormidium sp en función de la concentración de nitrógeno para su aprovechamiento biotecnológico. EA Segoviano, AA Islas Jóvenes en la ciencia 3 (1), 149-153 3 2017. Aislamiento, identificación y curva de crecimiento de la microalga Scenedesmus obliquus con fines biotecnológicos. CGP Vázquez. Universidad de Guanajuato. Identificación de algas y cianobacterias CER Cárdenas Universidad de Guanajuato. Hacia el reemplazo de pesticidas químicos. explorando las microalgas para su uso en control biológico VS Laura, AI Alberto, CMJ Gualberto. Análisis de Parámetros de Operación para el Desarrollo de una Ficocelda para Fines Energéticos AA ISLAS Universidad de Guanajuato. Determinación de la curva de crecimiento de Chlorococcum sp., en función de la concentración de nitrógeno. GGT Bravo Universidad de Guanajuato. Caracterización fisicoquímica y microbiológica de afluentes y efluentes líquidos de un biodigestor alimentado con residuos agrícolas AEG Alfaro, Universidad de Guanajuato. Caracterización de acidez y perfil de sólidos en aguas naturales de la región geotérmica de los azufres MGV Zárate Universidad de Guanajuato. Desarrollo de un sistema de digestión anaerobia para tratar residuos de brócoli (Brassica oleracea). Guanajuato.
Reyna Alvarado-Villanueva: Bióloga. Maestría (Laboratorio de Biología Acuática en la Facultad de Biología), Universidad Michoacana de San Nicolás de Hidalgo. Profesor e Investigador Asociado "A" de T/C (Laboratorio de Biología Acuática), Universidad Michoacana de San Nicolás de Hidalgo Facultad de Biología: Morelia, Michoacán, México.
Sandy Fabiola Andrade-Hernández: Bióloga. Laboratorio Biología Acuática, Facultad de Biología, Universidad Michoacana de San Nicolás de Hidalgo, Morelia, Michoacán, México.
José Luis Castro-Guillén: Doctor en Ciencias en la especialidad de biotecnología de Plantas. Ingeniería bioquímica. Tecnológico Nacional de México / Instituto Tecnológico Superior de Irapuato, Irapuato, Guanajuato, México.