
Acerca de la anatomía de agapanto (Agapanthus praecox subsp. praecox, Amaryllidaceae)
About the anatomy of Agapanthus (Agapanthus praecox subsp. praecox, Amaryllidaceae)
RESUMEN
El agapanto (Agapanthus praecox) es una hierba perenne perteneciente a la familia Amaryllidaceae, de importancia económica, dados sus usos medicinales y ornamentales y ecológica ya que está reportada como especie invasora. A pesar de esto, no hay estudios anatómicos que permitan dilucidar estructuras y que sirvan como base para en próximos estudios explicar sus adaptaciones y utilidades. Por lo anterior, este trabajo tuvo como objetivo realizar una aproximación descriptiva a la anatomía de órganos vegetativos y reproductivos femeninos de A. praecox subsp. praecox. Para ello, se realizaron cortes transversales a mano alzada y posteriormente se aplicó tinción Astra blue-fucsina. Fue común la presencia de cristales de oxalato de calcio tipo rafidios, un amplio tejido de almacenamiento en la raíz y el rizoma, y, específicamente para la raíz y la hoja, se encontraron canales secretores. En la parte reproductiva se observó un escapo con varias capas de clorénquima y esclerénquima, el ovario presenta placentación axilar y nectarios septales característicos de la familia. Por último, es necesario continuar con estudios de histoquímica e identificación de metabolitos que permitan explicar su éxito en diferentes condiciones y beneficios en la medicina.
Palabras clave: Adaptaciones; plantas introducidas; lirio africano.
ABSTRACT
Agapanthus (Agapanthus praecox) is a perennial herb belonging to the Amaryllidaceae family, of economic importance, given its medicinal and ornamental uses, and ecological since it is reported as an invasive species. Despite this, there are no anatomical studies that allow us to elucidate structures and serve as a basis for explaining their adaptations and uses in future studies. Therefore, this work aimed to carry out a descriptive approach to the anatomy of vegetative and female reproductive organs of A. praecox subsp. praecox. To do this, freehand cross sections were made, to which Astra blue-fuchsin stain was subsequently applied. The presence of raphid-type calcium oxalate crystals, extensive storage tissue in the root and rhizome, and, specifically for the root and leaf, secretory channels were found. In the reproductive part, a scape with several layers of chlorenchyma and sclerenchyma was observed, the ovary presents axillary placentation and septal nectaries characteristic of the family. Finally, it is necessary to continue with histochemistry studies and identification of metabolites that explain its success in different conditions and benefits in medicine.
Keywords: Adaptations; introduced plants; African lily.
INTRODUCCIÓN
Agapanthus praecox subsp. praecox, comúnmente llamada agapanto o lirio de África, es una planta de hábito herbáceo, perenne y rizomatosa. Sus hojas son coriáceas, lineales, en forma de correa y miden de 60 a 70 cm de largo y de 2 a 6 cm de ancho. Las flores son de color azul violeta, de 5 a 7 cm de largo, poseen 6 tépalos, 6 estambres y 3 carpelos y se agrupan en una inflorescencia tipo umbela sostenida por un pedúnculo bastante robusto de aproximadamente 1 m de altura (Snoeijer, 2004; Sharaibi & Afolayan, 2017).
Es originaria de la Provincia del Cabo Oriental de Sudáfrica, se encuentra desde el nivel del mar hasta alrededor de los 2.100 m (Snoeijer, 2004). Por su parte se reporta como planta invasora, la cual a pesar de que sus condiciones ambientales óptimas incluyen sol y semisombra, un suelo bien drenado y con abundante materia orgánica, esta especie también tiene la capacidad de tolerar heladas, calor, viento y sal (Global Invasive Species Database, 2022). Su polinización es entomófila (Delucchi & Hurrell, 2009). Se reproduce principalmente por semilla, cuya dispersión es eficaz a través del viento, agua, desechos de jardín y suelo contaminado, sin embargo, la reproducción también se da a través de rizoma por lo que rebrota a menudo y logra formar matas densas que provocan la exclusión de otra vegetación (Global Invasive Species Database, 2022). En Colombia, se registra como una especie con un alto riesgo de invasión en el altiplano del oriente antioqueño (García Duque et al., 2016).
El agapanto es una planta de gran interés en la medicina popular sudafricana dado que es considerada una planta de fertilidad y embarazo, se usa en el tratamiento de enfermedades del corazón, parálisis, resfriados, tos y molestias en el pecho. Se le han atribuido propiedades antiinflamatorias, antibacterianas, antifúngicas, antitumorales e inmunorreguladoras. Es una de las especies más utilizadas en el sur de África para tratar dolencias asociadas al sistema nervioso central (Sharaibi & Afolayan, 2017). No obstante, se ha registrado que las hojas pueden causar irritación en la piel y la savia en los ojos (Snoeijer, 2004). En lo que respecta a la fitoquímica, para el género se ha reportado la presencia de flavonoles, fitoecdisteroides, saponinas esteroides y antocianinas (Delucchi & Hurrell, 2009).
La mayoría de estudios realizados para esta especie están enfocados en la propagación in vitro dada su importancia ornamental. Sólo se encontró una investigación relacionada con la micromorfología (Sharaibi & Afolayan, 2017) y otra a la fitoquímica de la hoja (Sharaibi & Afolayan, 2018). A nivel anatómico se halló un artículo asociado al desarrollo floral (Fishchuk, 2021) y una comparación de la flor con A. africanus (Zhang et al., 2011). Dada su importancia ecológica, medicinal y económica, se hacen necesarios estudios de descripción y caracterización anatómica. Por lo tanto, el objetivo de este trabajo fue realizar una descripción anatómica de órganos vegetativos: rizoma, raíz y hoja, y, reproductivos: escapo y ovario utilizando tinción Astra blue-fucsina.
MATERIALES Y MÉTODOS
Material vegetal
El material vegetal se seleccionó según el criterio del tercio medio, en donde se colectaron órganos que se encontraran en una etapa media de crecimiento (ni jóvenes, ni maduros) de 5 individuos de A. praecox subsp. praecox que crecían de manera contigua, en el jardín del departamento de biología de la Universidad Nacional de Colombia, en julio de 2023. En el caso de las flores, se encontraban en antesis.
Anatomía
Se realizaron cortes transversales a mano alzada con cuchillas Minora, de raíz, tallo, hoja, ovario y pedúnculo. Luego de ello, se dispusieron en un portaobjetos de vidrio, hidratando con agua destilada. Posteriormente se tiñeron todos los cortes con tinción Astra blue-Fucsina (Astra-blue acidificado al 1% y fucsina básica etanólica), cada uno por un tiempo de 3 minutos. En cada caso se lavó el colorante con agua destilada, y se cubrió con laminilla. Para el caso específico de los estomas, los cortes fueron paradérmicos y no se aplicó ningún tipo de tinción. Los tejidos se observaron bajo un microscopio Leica DM500 y fueron fotografiados con una cámara Leica ICC50 W, con el Software Leica LAS EZ en el laboratorio 101 del Departamento de Biología de la Universidad Nacional de Colombia, Sede Bogotá. Finalmente, la escala de las imágenes se colocó con el programa ImageJ 1.53t (Java 1.8.0_345) y para la elaboración de las planchas fotográficas se utilizó Inkscape.
RESULTADOS Y DISCUSIÓN
En general, la anatomía observada en los diferentes órganos de A. praecox subsp. praecox coincide con lo que se ha reportado hasta el momento para la familia (Arroyo & Cutler, 1984; Meerow & Snijman, 1998; Özdemir & Alçitepe, 2010; Takos & Rook, 2013) y el género (Fishchuk, 2021; Sharaibi & Afolayan, 2017), así como con las características típicas de una monocotiledónea (Zotz et al., 2017). Por otro lado, se encontraron estructuras particulares, como canales secretores en la hoja y la raíz, y, rafidios en casi todos los órganos con excepción del rizoma, siendo la hoja, el órgano en donde se identificaron en mayor abundancia.
Anatomía de raíz
Las raíces son fasciculadas, engrosadas, carnosas y abundantes (figura 1a). En el corte transversal de raíz se evidenciaron numerosos pelos radicales unicelulares y transparentes, una epidermis de una célula de grosor, acompañada de alrededor de dos a tres capas de velamen (figura 1d). Se observó una región del parénquima cortical formada por varias células parenquimáticas, aproximadamente unas 38 filas (figura 1b), con canales secretores (figura 1e) y cristales de oxalato de calcio a manera de rafidios (figura 1f) inmersos. En la parte interna, se encontró una endodermis y un periciclo uniseriados, y, el sistema vascular organizado en polos de xilema y floema alternados (figura 1c).
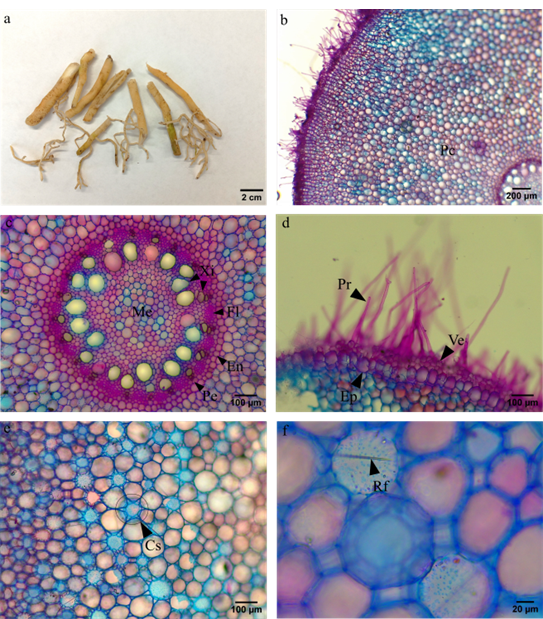
Figura 1. Raíz. a. Morfología externa. Corte transversal de raíz, con detalle de: b. Parénquima cortical (Pc) c. Endodermis (En), periciclo (Pe), floema (Fl), xilema (Xi) y médula de parénquima (Me) d. Pelos radicales (Pr), velamen (Ve) y epidermis (Ep) e. Canal secretor (Cs), f. Rafidio (Rf).
La raíz presenta la anatomía típica de una monocotiledónea, no hay un engrosamiento de la endodermis, lo que se ha observado para otros taxones de la familia (Galanthus gracilis, Pancratium maritimum L. y Leucojum aestivum L) (Özdemir & Alçitepe, 2010;). Respecto al velamen encontrado, es característico del género (Fishchuk, 2021) y si bien su función ha sido mejor caracterizada para epífitas de la familia Orchidaceae, en el caso de monocotiledóneas terrestres se ha planteado que estaría relacionada con evitar el daño mecánico (colapso de la corteza y posterior muerte de la raíz) provocado por cambios en la humedad del suelo en hábitats terrestres que presentan sequías en ciertos períodos de tiempo (Zotz et al., 2017). Adicionalmente, la presencia de abundantes pelos radicales refleja una mayor superficie de absorción de agua (Cenizo et al., 2013). Por otro lado, para otras especies de la familia se ha encontrado que los canales secretores inmersos en el parénquima cortical almacenan alcaloides cuya función sería evitar la herbivoría y podrían ser prometedores en la industria farmacéutica (Takos & Rook, 2013). Teniendo en cuenta que se ha reportado el uso de la infusión de la raíz de A. praecox en la medicina popular sudafricana como anticancerígeno (Sharaibi & Afolayan, 2017), valdría la pena profundizar en estudios histoquímicos de este órgano para determinar la presencia de ciertos metabolitos.
Anatomía del rizoma
El rizoma de A. praecox es erecto y reducido (figura 2a), presenta una organización de los haces vasculares tipo atactostela (figura 2c), es decir, están dispuestos de forma dispersa y además, en ella se evidenciaron trazas foliares. La corteza y el felógeno presentaron aproximadamente 7 filas de células (figura 2b). En el parénquima se observaron abundantes inclusiones citoplasmáticas (figura 2e). Por su parte, los haces vasculares son colaterales cerrados (figura 2f).
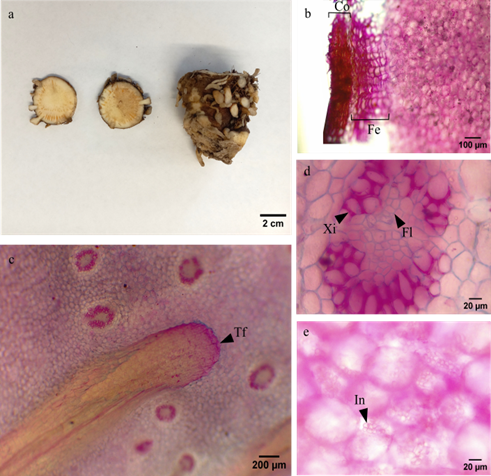
Figura 2. Rizoma. a. Morfología. Corte transversal: b. Corteza (Co), felógeno (Fe) c. Disposición de haces tipo atactostela, traza foliar (Tf) d. Haz vascular, xilema (Xi), floema (Fl) e. Inclusiones citoplasmáticas (In).
La gran cantidad de inclusiones citoplasmáticas pueden permitirle a la planta sobrevivir en condiciones desfavorables y además podrían dar indicios de los usos tradicionales que se le han dado a este. No obstante, Sharaibi & Afolayan, (2017) plantean que es en los elementos traqueales del xilema en donde se almacenan y producen los fitoquímicos responsables de las actividades terapéuticas. Por lo tanto, hacen falta realizar pruebas histoquímicas que comprueben y determinen los compuestos que pueden estar almacenando y su ubicación.
Anatomía de hoja
La hoja es cóncava, sésil, lanceolada, de margen entero y con nerviación paralelinervia (figura 3a). En el corte transversal, se encontró una variación de la base al ápice, en donde en la base de la hoja, no hay presencia de cloroplastos y se observan los haces vasculares más unidos en el mesófilo (figura 3b). Mientras que en los cortes de la parte media y apical ya se observa la presencia de pigmentos fotosintéticos, así como también haces vasculares más separados (figura 3c). El parénquima en el mesófilo es uniforme dado que en monocotiledóneas no hay diferenciación en empalizada y esponjoso (figuras 3c y 3e), y está conformado por células ovaladas dispuestas en estratos. En la parte media de la hoja y en la mitad del mesófilo es más clara la presencia de canales secretores circulares y células mucilaginosas de forma redondeada, alargada y de mayor tamaño respecto al parénquima fotosintético (figura 3d).
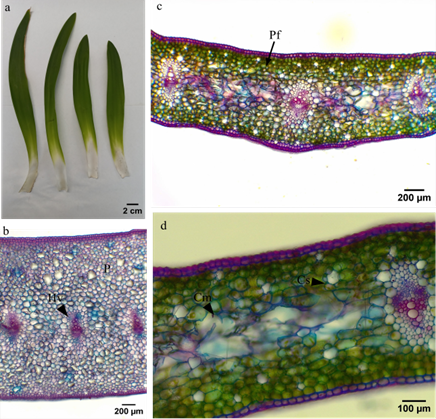
Figura 3. Hoja. a. Morfología externa. Anatomía foliar en corte transversal: b. Parte basal, haz vascular (hv), parénquima (p) c. Parte media, parénquima fotosintético (Pf) d. Célula mucilaginosa (Cm), canal secretor (Cs).
La epidermis es uniseriada, en la parte adaxial la pared celular externa presenta proyecciones a manera de triangulo, en contraste, el lado abaxial es mayormente ovalado (figuras 4a y 4b). Las células epidermales son poligonales (figuras 4c y 4d), los estomas son de tipo anomocítico, no sobresalen de la epidermis (figuras 4a y 4b) y se encontraron en el haz y el envés por lo que se trata de una hoja anfiestomática. En la parte abaxial y adaxial se distinguieron de forma clara las células oclusivas, ostiolo y células acompañantes (figuras 4c y 4d). Se lograron observar inclusiones citoplasmáticas (figura 4e) junto a los haces vasculares y numerosos depósitos de cristales de oxalato de calcio tipo rafidios, dispuestos en paquetes (figura 4f).
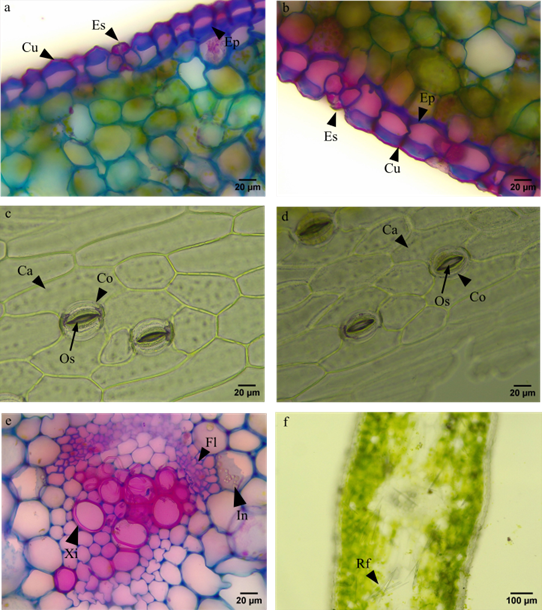
Figura 4. Hoja. Acercamiento de: a. Cara adaxial, cutícula (Cu), epidermis (Ep), estoma (Es) b. Parte abaxial. Corte paradérmico en: c. Haz, célula oclusiva (Co), célula acompañante (Ca), ostiolo (Os) d. Envés e. Haz vascular, floema (Fl), Xilema (Xi), inclusiones citoplasmáticas (In) f. Rafidios (Rf).
Lo encontrado en la hoja de agapanto coincide con lo esperado para la familia, en donde no es común la presencia de tricomas (Arroyo & Cutler, 1984; Meerow & Snijman, 1998). Se han observado en la mayoría de especies células mucilaginosas (Meerow & Snijman, 1998). Asimismo, las hojas son anfiestomáticas, lo que concuerda con lo reportado por Sharaibi & Afolayan, (2017). Por otro lado, una adaptación que evita la deshidratación es la presencia de células mucilaginosas inmersas en el parénquima fotosintético (Perrone et al., 2015). Lo anterior, explica la capacidad de la planta para amortiguar el estrés por sequía, como lo observaron Perrone y colaboradores (2015) en P. maritimum. En cuanto a las inclusiones y los canales secretores encontrados en el mesófilo, se ha registrado la presencia de taninos, fenoles, proantocianidinas, flavonoides y flavanoles en extractos de hoja (Sharaibi & Afolayan, 2018), por lo que es necesario profundizar e identificar los compuestos que pueden estar almacenando estas estructuras en específico.
A la presencia de cristales de oxalato formando rafidios para el caso de la raíz y las hojas (lo que es frecuente en la familia) (Meerow & Snijman, 1998) se le atribuyen distintas funciones dentro de las que están la regulación de calcio, la desintoxicación de aluminio, defensa contra herbivoría. Esta última, es una de las funciones que se ha observado para las Amaryllidaceas, en donde para el caso de un lirio se observó que tres especies de herbívoros sólo consumen el ápice de las hojas (Konno et al., 2014).
Parte reproductiva
El escapo de la inflorescencia es macizo (figura 5a). Al detallar el corte transversal (figuras 5c, 5d y 5e) se observa una epidermis uniseriada y no se encontraron tricomas. Se evidencia una amplia vascularización, los haces vasculares son colaterales cerrados y están rodeados de esclerénquima (figura 5d). Externamente se distingue clorénquima en la corteza, con aproximadamente 10 capas (figura 5d), y estomas (figura 5e). Presentó una médula parenquimática y las células mucilaginosas no se lograron visualizar (figura 5c). Respecto al ovario (figura 5b), es supero, tricarpelar y trilocular. Posee una placentación de los óvulos tipo axilar y se identificó la presencia de nectarios septales entre los lóculos (figura 5f). La epidermis es uniseriada (figura 5h) y sus paredes celulares externas poseen proyecciones (figura 5i). Por último, se identificaron una gran cantidad de rafidios organizados en paquetes (figura 5i).
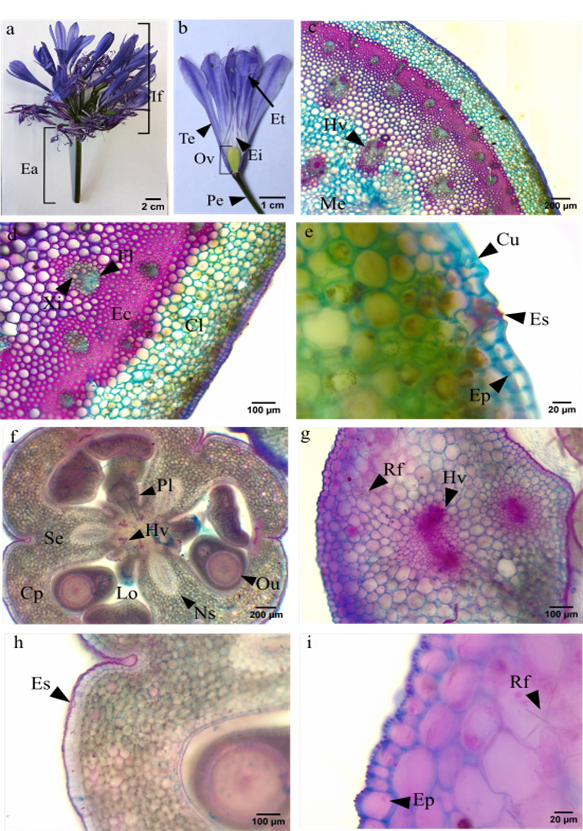
Figura 5. Anatomía y morfología de la parte reproductiva. a. Inflorescencia (If), escapo (Ea) b. Flor, pedúnculo (Pe), tépalo (Te), ovario (Ov), estilo (Ei), estambre (Et). Corte transversal de escapo: c. Haz vascular (Hv) d. Clorénquima (Cl), esclerénquima (Ec), Xilema (Xi), floema (Fl) e. Cutícula (Cu), estoma (Es), epidermis (Ep). Anatomía del ovario: f. Placenta (Pl), ovulo (Ou), septo (Se), nectario septal (Ns), loculo (Lo), carpelo (Cp) g. Rafidios (Rf). Detalle de: h. Estoma i. Epidermis.
Según lo reportado para la familia por Arroyo & Cutler (1984) las células que separan la corteza y el cilindro central serían esclerénquima, lo que le brinda estabilidad a la inflorescencia. El nectario septal encontrado en el ovario es representativo del género Agapanthus y de la familia Amaryllidaceae, además, se confirmó que este nectario no presenta cutícula, lo que es característico de este género (Fishchuk, 2021).
CONCLUSIÓN
Este trabajo representa una contribución importante a la ciencia básica, dado que a nivel anatómico sería la primera descripción detallada de todas las estructuras vegetativas, así como del ovario y escapo de la especie. Las características anatómicas encontradas en A. praecox subsp. praecox, coinciden con lo reportado para la familia y el género. Por otro lado, estructuras como los cristales de oxalato de calcio, canales secretores, inclusiones citoplasmáticas, raíces con varias capas de parénquima cortical y la presencia de mucílago, podrían dar indicios de diferentes adaptaciones que presenta esta planta a ambientes adversos y por tanto contribuyen a su éxito como especie invasora. Finalmente, hace falta realizar más estudios anatómicos, con un enfoque de histoquímica y fitoquímica, que permitan dilucidar y explicar los usos medicinales que tradicionalmente las comunidades le han dado a esta planta, ampliamente utilizada a nivel ornamental.
AGRADECIMIENTOS
Agradezco al profesor Xavier Marquínez Casas por el apoyo brindado en la asignatura Espermatofitos, en la que fue posible realizar este trabajo. A la Universidad Nacional de Colombia por prestar sus instalaciones y equipos. Al profesor Jaime Uribe por sus observaciones y sugerencias. A Andrés Fonseca por su colaboración en la identificación taxonómica de la especie. Finalmente, a Víctor Giral, Jorge Apache y Tannia Revelo por su apoyo en los cortes realizados.
LITERATURA CITADA
Arroyo, S. C., & Cutler, D. F. (1984). Evolutionary and Taxonomic Aspects of the Internal Morphology in Amaryllidaceae from South America and Southern Africa. Kew Bulletin, 39(3), 467. https://doi.org/10.2307/4108592
Cenizo, V. J., Mazzola, M. B., Corró Molas, B. M., & Kin, A. G. (2013). Características morfológicas y anatómicas de las plántulas de Trichocereus candicans (Cactaceae). Boletín de la Sociedad Argentina de Botánica, 48(3-4), 443-451.
Delucchi, G., & Hurrell, J. (2009). Flora Rioplatense 3(4): Agapanthaceae (pp. 11-18).
Fishchuk, O. S. (2021). Comparative flower morphology of Agapanthus africanus and A. praecox (Amaryllidaceae). Regulatory Mechanisms in Biosystems, 12(4), 620-627. https://doi.org/10.15421/022185
García Duque, J. J., Franco Ospina, M. C., Cardona Ramírez, D. E., & Quijano Abril, M. A. (2016). Categorización y análisis de la distribución de especies introducidas, establecidas e invasoras del Oriente Antioqueño. En Flora del Oriente Antioqueño. Biodiversidad, ecología y estrategias de conservación (pp. 109-136). Fondo Editorial Universidad Católica de Oriente.
Global Invasive Species Database. (2022, diciembre 14). Species profile: Agapanthus praecox. http://www.iucngisd.org/gisd/species.php?sc=1724
Konno, K., Inoue, T. A., & Nakamura, M. (2014). Synergistic Defensive Function of Raphides and Protease through the Needle Effect. PLoS ONE, 9(3), e91341. https://doi.org/10.1371/journal.pone.0091341
Meerow, A. W., & Snijman, D. A. (1998). Amaryllidaceae. En K. Kubitzki (Ed.), Flowering Plants · Monocotyledons (pp. 83–110). Springer Berlin Heidelberg. https://doi.org/10.1007/978-3-662-03533-7_11
Özdemir, C., & Alçitepe, E. (2010). Morphological and anatomical study on Galanthus gracilis (Amaryllidaceae). Acta Botanica Hungarica, 52(1-2), 151-157. https://doi.org/10.1556/ABot.52.2010.1-2.13
Perrone, R., Salmeri, C., Brullo, S., Colombo, P., & De Castro, O. (2015). What do leaf anatomy and micro-morphology tell us about the psammophilous Pancratium maritimum L. (Amaryllidaceae) in response to sand dune conditions? Flora - Morphology, Distribution, Functional Ecology of Plants, 213, 20-31. https://doi.org/10.1016/j.flora.2015.03.001
Sharaibi, O. J., & Afolayan, A. J. (2017). Micromorphological Characterization of the Leaf and Rhizome of Agapanthus praecox subsp. praecox Willd. (Amaryllidaceae). Journal of Botany, 2017, 1-10. https://doi.org/10.1155/2017/3075638
Sharaibi, O. J., & Afolayan, A. J. (2018). Phytochemical Analysis and Toxicity Evaluation of Acetone, Aqueous and Methanolic Leaf Extracts of Agapanthus praecox Willd. Journal of Complementary Medicine & Alternative Healthcare, 7(5). https://doi.org/10.19080/JCMAH.2018.07.555722
Snoeijer, W. (2004). Agapanthus: A revision of the genus. Timber Press, in association with the Royal Boskoop Horticultural Society.
Takos, A., & Rook, F. (2013). Towards a Molecular Understanding of the Biosynthesis of Amaryllidaceae Alkaloids in Support of Their Expanding Medical Use. International Journal of Molecular Sciences, 14(6), 11713-11741. https://doi.org/10.3390/ijms140611713
Zhang, D., Shen, X., & Zhuo, L. (2011). Flower Development and Anatomy of Agapanthus praecox ssp. orientalis (Leighton) Leighton. Agricultural Sciences in China, 10(9), 1365-1373. https://doi.org/10.1016/S1671-2927(11)60129-6
Zotz, G., Schickenberg, N., & Albach, D. (2017). The velamen radicum is common among terrestrial monocotyledons. Annals of Botany, 120(5), 625-632. https://doi.org/10.1093/aob/mcx097
BIODATA
Laura Valeria Cubillos Ariza: Bióloga, Universidad Nacional de Colombia.