
DISTRIBUCIÓN TEMPORAL Y ESPACIAL DE ESPECIES DE CLADÓCEROS MARINOS EN UNA ZONA HIPÓXICA DEL GOLFO DE CARIACO (MAR CARIBE SURORIENTAL)
Temporal and spatial distribution of marine cladocera species in a hypoxic area of the gulf of Cariaco (southeast Caribbean Sea)
RESUMEN
Los cladócera en ambientes costeros ocupan un lugar preponderante en la trama trófica pelágica después de los copépodos. Se evaluó la composición, abundancia y distribución vertical de los Cladocera en la depresión de Guaracayal, Golfo de Cariaco, Venezuela. Los muestreos se realizaron bimensualmente entre abril 2012 y abril 2013. Las muestras de agua fueron recolectadas con una botella de Niskin (5L) a 5, 25, 45 y 75m, para determinar la concentración de oxígeno disuelto y Chl a. Se utilizó una red cónica de zooplancton de apertura-cierre con mensajero de profundidad, de 300 µm de abertura de malla; el calado se realizó de manera oblicua, a una velocidad de 2 nudos durante 10 min. Se midió la temperatura y la salinidad por medio de una sonda multiparamétrica (YSI). Se evidenció el fenómeno de surgencia costera estacional entre diciembre 2012 y abril 2013, asociado con registros de baja temperatura (<19ºC), alta salinidad (>37) y Chl a. La concentración de oxígeno disuelto disminuyó (< 1 mg L-1) por debajo de los 60 m de profundidad entre octubre y noviembre 2012 (período de estratificación). Se identificaron 4 especies de cladóceros: Penilia avirostris, Pseudoevadne tergestina, Evadne spinifera y Pleopis polyphemoides. Se observó la mayor abundancia en abril 2012 y 2013 a nivel superficial (5m) y las menores abundancias se hallaron en octubre 2012. P. tergestina fue la especie más abundante, registrándose en todos los meses muestreados e incluso se halló en el estrato anóxico, seguido de P. avirostris; en menor proporción se reconocieron a E. spinifera y P. polyphemoides. Dos factores fisicoquímicos, la temperatura y salinidad, fueron los principales impulsores de los cambios en la composición de los Cladocera.
Palabras clave: Cladóceros marinos; depresión de Guaracayal; golfo Cariaco; surgencia costera; zooplancton.
ABSTRACT
Cladocerans in coastal environments occupy a predominant place in the pelagic food web after copepods. The composition, abundance and vertical distribution of Cladocera were evaluated in the Guaracayal depression, Gulf of Cariaco, Venezuela. Sampling was carried out bimonthly between April 2012 and April 2013. Water samples were collected with a Niskin bottle (5L) at 5, 25, 45 and 75m, to determine the concentration of dissolved oxygen and Chl a. A conical opening-closing zooplankton net with depth messenger, 300 µm mesh opening, was used; the setting was carried out obliquely, at a speed of 2 knots for 10 min. Temperature and salinity were measured by means of a multiparameter probe (YSI). The phenomenon of coastal upwelling was evident between December 2012 and April 2013, associated with records of low temperature (<19ºC), high salinity (>37) and Chl a. The concentration of dissolved oxygen decreased (< 1 mg L-1) below 60 m depth between October and November 2012 (stratification period). Four species of cladocerans were identified: Penilia avirostris, Pseudoevadne tergestina, Evadne spinifera and Pleopis polyphemoides. The highest abundance was observed in April 2012 and 2013 at the surface level (5m) and the lowest abundances were found in October 2012. P. tergestina was the most abundant species, being recorded in all the months sampled and was even found in the anoxic stratum, followed by P. avirostris; to a lesser extent E. spinifera and P. polyphemoides were recognized. Two physicochemical factors, temperature and salinity, were the main drivers of changes in the composition of Cladocera.
Key words: marine cladocerans; Guaracayal depression; Cariaco Gulf; coastal upwelling; zooplankton.
INTRODUCCIÓN
Dentro del grupo de organismos zooplanctónicos marinos, se encuentran los Cladocera, conformado por pequeños crustáceos que comprenden más de 650 especies a nivel mundial (Forró et al., 2008), agrupados en los Branchiópoda (Fryer, 1987; Paggi, 2004). En contraste con la alta diversidad de especies de agua dulce, solo 8 especies son conocidos de hábitats pelágicos marinos (Egloff et al., 1997).
Este grupo se distribuye ampliamente desde aguas tropicales a subpolares. Están densamente distribuidos en áreas costeras (Tang et al., 1995; Onbé et al., 1996; Marazzo y Valentín, 2000), especialmente en ensenadas y bahías con aportes fluviales (Terbıyık et al., 2018). Además, algunos de sus miembros también están ampliamente distribuidos en mar abierto (Onbé, 1999).
Los Cladocera contribuyen significativamente a los ciclos de materia y energía, ya que juegan un papel importante en la cadena alimentaria (Killi, 2020; Rosa et al., 2022); no siempre son los más abundantes a lo largo del año, en algunas ocasiones pueden destacar en importancia numérica y así contribuir al control de arriba hacia abajo (top-down) porque es un grupo herbívoro (Sommer y Sommer, 2006). Los Cladocera constituyen una de las principales dietas de peces pelágicos y larvas de peces, debido a su lenta respuesta de escape (Verity y Smetacek, 1996; Marazzo y Valentin, 2000, 2001). En general, su distribución vertical está limitada por las aguas superficiales y se encuentran densamente por encima de los 15 m (Onbé et al., 1996; Marazzo y Valentín, 2000), pero pueden detectarse en zonas anóxicas (Seergeva y Gulin, 2007). Además, la rápida proliferación a través de la reproducción partenogenética y alta tasa de natalidad en condiciones óptimas (tanto de temperatura como disponibilidad de alimentos) hace que estas especies sean preferibles por los consumidores en ecosistemas marinos y de agua dulce (Dodson et al., 2010; Killi, 2020).
Entre los principales factores que pueden afectar la distribución espacio-temporal de estos zooplanctobiontes, están la disponibilidad de alimentos, la temperatura y la salinidad (Neves et al., 2003; Wooldridge y Deyzel, 2009). Por su parte, Terbiyik-Kurt y Polat (2014) han señalado que el patrón estacional de la población de cladóceros varió notablemente con cambios en la salinidad. Por lo tanto, es necesario establecer la variación interanual de las poblaciones de cladóceros con relación a la variabilidad hidrográfica, para comprender los patrones estacionales de ocurrencia.
En el ambiente marino el cladócero Penilia avirostris Dana, 1849 es una de las especies más abundantes en aguas tropicales, subtropicales y templadas (Rose et al., 2004), mientras que las especies Evadne spinifera Müller, 1867, Pseudevadne tergestina Claus, 1877, Pleopis polyphemoides (Leuckart, 1859) y Pleopis schmackeri (Poppe, 1889) también son comunes en zonas tropicales (Ramírez, 1981; Monteiro-Ribas et al., 2013).
De los Cladocera marinos conocidos mundialmente, cinco especies han sido reportadas en las costas de Venezuela (Penilia avirostris, Evadne spinifera, Pseudevadne tergestina, Pleopis polyphemoides y Pleopis schmackeri). Sin embargo, los estudios de los cladóceros marinos en el país son escasos y restringidos a ciertas regiones. Destacan el de Casanova et al. (2007) en el Parque Nacional Archipiélago Los Roques. Scott-Frías y Zoppi (2010) describen por primera vez huevos de resistencia de P. avirostris en la costa noroeste de Falcón y Scott-Frías (2011) en la misma zona, estudió la estructura poblacional de las especies planctónicas de ostrácodos y cladóceros; Guerrero et al. (2016) citan por primera vez a P. avirostris y P. tergestina en la boca San Carlos, en el Sistema de Maracaibo, Zulia. En la región oriental, resaltan los trabajos de Zoppi y Palacios (2005), Gómez y Hernández (2008), Márquez-Rojas et al. (2006, 2011, 2016) y Márquez-Rojas y Zoppi (2017). En estudio más reciente, Segovia (2017) analizó los copépodos y cladóceros en época de surgencia en la bahía de Mochima; en este mismo lugar, Bravo (2019) estudió la composición, abundancia y distribución de los branchiopoda marinos.
El golfo de Cariaco es una cuenca tectónica ubicada en la región nororiental de Venezuela (Okuda et al., 1978; Caraballo, 1982). En ese sentido, los procesos de convección y afloramiento tienden a desarrollar fenómenos de renovación de las aguas superficiales cálidas por aguas subsuperficiales de temperaturas más bajas y ricas en sustancias nutritivas, estimulando el desarrollo planctónico (Bonilla et al., 1993). Por consiguiente, comprender los cambios en la estructura de la comunidad zooplanctónica en función de la variabilidad ambiental a diferentes escalas de tiempo y espacio, es primordial para la descripción del funcionamiento y productividad biológica de esta masa de agua tan importante para el oriente de Venezuela, en especial por constituir una de las 5 regiones que conforman el área de distribución y de pesca artesanal más importante en el nororiente de Venezuela, con el principal recurso pesquero sardina (Sardinella aurita) (Quintero et al., 2002).
Debido a lo antes expuesto, los cladóceros, después de los copépodos, son un eslabón trófico clave en las comunidades acuáti cas, por lo que el análisis de su biología y los factores que afectan los eventuales blooms, son importantes para entender el funcionamiento de las masas de agua (Sala et al., 2015). Por lo tanto, el objetivo principal del presente estudio es evaluar la composición, abundancia y distribución vertical de los cladóceros marinos en relación a los factores ambientales en la depresión de Guaracayal, golfo de Cariaco, Venezuela.
MATERIALES Y MÉTODOS
Área de estudio
El golfo de Cariaco, ubicado en la costa nororiental de Venezuela al este de la cuenca de Cariaco, forma parte del Mar Caribe Suroriental (Okuda et al., 1978). Dicho golfo presenta gran influencia de la surgencia costera estacional, la cual está fuertemente asociada con el régimen de los vientos alisios (Jury, 2017; Rueda-Roa et al., 2018). La topografía del fondo marino del golfo de Cariaco en la costa sur revela la presencia de una depresión pequeña y alargada en dirección este-oeste, denominada depresión de Guaracayal (10º28'30’’N y 63º58’00’’O; Fig. 1), de 8 km de largo y 2 km de ancho. Esta depresión es al menos, 15 m más profunda que el fondo adyacente del golfo y alcanza una profundidad máxima entre 85 - 90 m (Caraballo, 1982; Audemard et al., 2007). Los bordes tanto al este como al oeste de la depresión de Guaracayal, están constituidos por elevaciones topográficas (Caraballo, 1982), que limitan las condiciones para un intercambio considerable de sus masas de agua a profundidades mayores de 70 m, resaltando la condición de aguas anóxicas (Caraballo, 1982; Audemard et al., 2007).
Toma de las muestras hidrográficas
Las muestras fueron recolectadas bimestralmente (abril 2012 - abril 2013) en la depresión de Guaracayal. En la estación de muestreo se midió la temperatura y la salinidad superficial por medio de una sonda multiparamétrica (YSI). La obtención de las muestras de agua se realizó con una botella de Niskin de 5 L de capacidad en los estratos a estudiar: 0, 25, 45 y 75 m de profundidad, posteriormente fueron vertidas en botellas plásticas de 225 mL y se almacenaron congeladas, hasta su posterior análisis. Se recolectaron muestras de agua para la determinación del oxígeno disuelto utilizando botellas Winkler (300 mL) y en botellas plásticas color ámbar (1.500 mL) para la determinación de clorofila a (Chl a).
Figura 1.- Ubicación geográfica de la depresión de Guaracayal en el golfo de Cariaco, estado Sucre, Venezuela.
Muestreo de cladóceros
La recolección de las muestras zooplanctónicas, donde se extrajeron los cladóceros, fue realizada utilizando una red cónica de zooplancton de apertura-cierre con mensajero de profundidad, de 60 cm de diámetro de boca y 150 cm de longitud con apertura de malla de 300 µm y flujómetro digital (General Oceanic), previamente calibrado aplicando el método estándar propuesto por Postel et al. (2000). Se realizaron dos arrastres oblicuos de la red en cada profundidad a estudiar (0, 25, 45 y 75 m), a una velocidad de 2 nudos durante 10 min. Cada muestra obtenida se vació en envases plásticos de 500 ml. Se fijó y preservó en formaldehido diluido al 4%, preparado con agua de mar filtrada y neutralizado con tetraborato de sodio (Postel et al., 2000).
Análisis en laboratorio
El oxígeno disuelto se determinó según el método de Winkler modificado por Parsons et al. (1984). La determinación de Chl a en superficie se realizó según el método descrito por Lorenzen (1967), modificado por Parsons et al. (1984), utilizando un espectrofotómetro GENESYS 8 (ColeParmer, Vernon Hills, IL, EUA), con un límite de detección de 0,01 mg. m-3.
Cladóceros
Las muestras de zooplancton fueron concentradas (400 mL) y se extrajeron 3 submuestras de 10 mL con una pipeta Stempel. Luego, se colocaron en una cámara de Bogorov y posteriormente fueron analizadas bajo un microscopio estereoscópico Motic® SMZ-168. A partir de esta muestra se procedió a cuantificar e identificar a las especies de cladóceros, empleando un microscopio óptico Motic® BA300, con la ayuda de los lentes objetivos de 10x y 40x. La ubicación taxonómica de los Cladóceros se realizó con las claves de identificación de Ramírez (1981, 1996) y Onbé (1999). Finalmente, la fase de observación terminó con la toma continua de fotos digitales para su posterior análisis y ayuda en la ubicación taxonómica. La abundancia de los cladóceros se expresó como Nº de cladóceros por volumen filtrado (Vf).
Análisis estadísticos
La independencia de las muestras en el zooplancton, se basa en la alta beta diversidad (tasa de recambio) (Lopes et al., 2017). Para establecer posibles diferencias espaciales (profundidad) y temporales (meses), se empleó la prueba de Kruskal-Wallis (KW, Wiedenhöfer, 1993), luego de comprobar el no cumplimiento de los supuestos de normalidad (prueba de Kolmogorov-Smirnov) y homocedasticidad (prueba de Levene) (Zar, 1996). En los casos de diferencias significativas se realizó la prueba a posteriori de Dunn para evaluar las diferencias en cada parámetro ambiental y la abundancia de los cladóceros. Las pruebas estadísticas, modelos, figuras exploratorias y demás rutinas se desarrollaron utilizando el Software Libre R v 4.2.2, bajo la interfaz gráfica R Studio (R Core Tean 2016). Los resultados fueron graficados en diagramas de cajas y bigotes (Box-Plot) para proporcionar una mejor representación visual de los análisis. Por último, para establecer la relación entre las variables físico químicas y los cladóceros, se realizó un análisis de correlación múltiple (Zar, 1996) usando el coeficiente de correlación de Spearman por rango, expresado en correlogramas.
RESULTADOS
Hidrografía
La temperatura del agua varió entre 18,9 y 29,5 ºC, con una media de 22,41 ± 3,21 ºC. Se detectaron diferencias temporales y verticales significativas (Test de Kruskall-Wallis= 12,14, KW= 8,14, p < 0,05; Test de Dunn: p < 0,05; Fig. 2a, b); los valores más bajos de todo el estudio (< 20 ºC) se registraron en febrero y abril 2013, mientras se observó estratificación marcada entre octubre y diciembre 2012, con los valores más altos. Con respecto, a la profundidad los mayores valores (21,4-29,5 ºC) se registraron en la superficie (> 25 m) y los menores (entre 19,5 y 20,5 ºC) a 75 m de profundidad.
La salinidad osciló entre 34,7 en abril 2013 y 40,7 en febrero 2013 (= 39,08 ± 1,81); las mayores fluctuaciones de esta variable se registraron en abril 2013 (6 unidades de variación); sin embargo, en este mismo mes, también se detectaron valores elevados de salinidad (>39) a nivel superficial. Este comportamiento es normal dentro de la variabilidad estacional en la región, cuando disminuye la intensidad de viento e inicia el periodo de lluvia. Se detectaron diferencias temporales significativas (KW= 11,46, p < 0,05; Test de Dunn: p < 0,05; Fig. 3 c), pero no entre las profundidades (KW= 4,10, p > 0,05; Fig. 3 d).
La concentración de oxígeno disuelto fluctuó entre 0,56 mg. l-1 en abril 2013 a 75 m de profundidad y 8,8 mg. L-1 en junio a 5 m (= 4,69 ± 2,08 mg L-1; Fig. 3e,f). Entre abril y octubre de 2012 se registraron valores elevados (> 5 mg L-1) por encima de los 45 m, mientras que a nivel profundo se reportaron aguas hipóxicas (1 – 3 mg L-1). Entre diciembre 2012 y febrero 2013 se detectaron valores bajos (< 4 mg L-1) en la superficie, y en abril 2013 los valores comenzaron a descender en toda la columna de agua (< 3 mg L-1), detectando aguas anóxicas en la capa profundad (< 0,60 mg L-1). No se encontraron diferencias temporales significativas (KW= 13,32, p > 0,05), pero sí con respecto a las profundidades (KW= 7,05, p < 0,05; Test de Dunn: p < 0,05; Fig. 3f), con los valores más elevados por encima de los 25 m de profundidad (> 6 mg L-1) y los más bajos (< 3 mg L-1) a mayores profundidades.
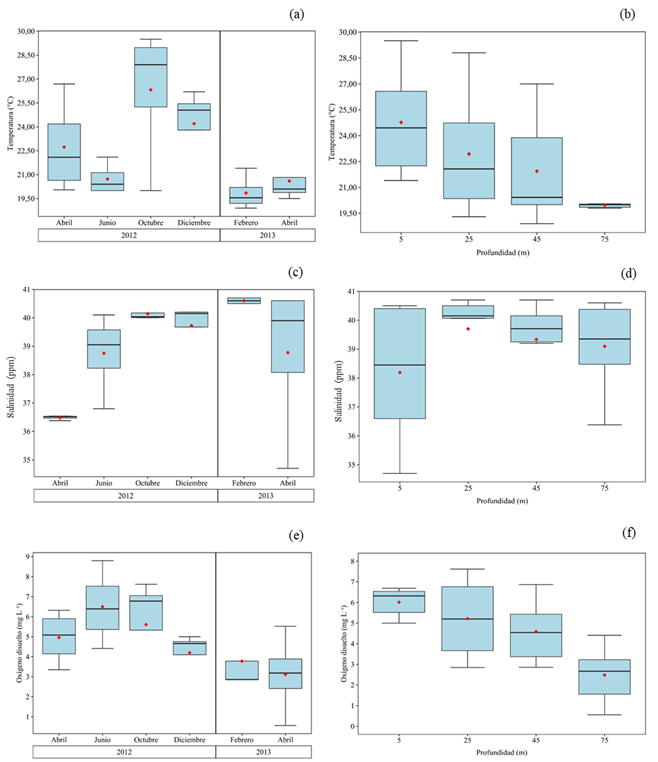
Figura 2.- (a, b) Variación temporal y espacial de la temperatura del agua (ºC), (c, d) de la salinidad (ups) y (e, f) del oxígeno disuelto en la depresión de Guaracayal, golfo de Cariaco, Venezuela.
Clorofila a (Chl a)
La concentración de Chl a varió entre no detectable (ND) en febrero y abril 2013 y 2,25 mg m-3 en abril 2012 (Fig. 3a); sin embargo, se hallaron valores muy elevados (10,1 y 12,6 mg m-3) en junio y diciembre 2012, los cuales se eliminaron en la figura, para una mejor representación de la tendencia de los datos. Entre abril y junio 2012, se registraron valores elevados (= 1,14 y = 1,69 mg m-3, respectivamente) por encima de los 25 m, y a partir de octubre 2012 disminuyó (0,5-1,0 mg m-3) en toda la columna de agua. En diciembre 2012 se registraron concentraciones relativamente elevadas (0,01 – 1,99 mg m-3; = 1,0 mg m-3) sobre los 25 m. Posteriormente en febrero y abril 2013, disminuyeron los valores de Chl a (ND-2,02 mg m-3) en toda la columna de agua (Fig. 3a). Se detectaron diferencias significativas solo entre las profundidades (KW= 9,46, p < 0,05; Test de Dunn: p < 0,05; Fig. 3b), las concentraciones de Chl a más elevadas (0,55 – 2,25 mg m-3) fueron registradas a nivel superficial (5-25 m) y las más bajas (0,0-1,55 mg m-3) a 75 m de profundidad.
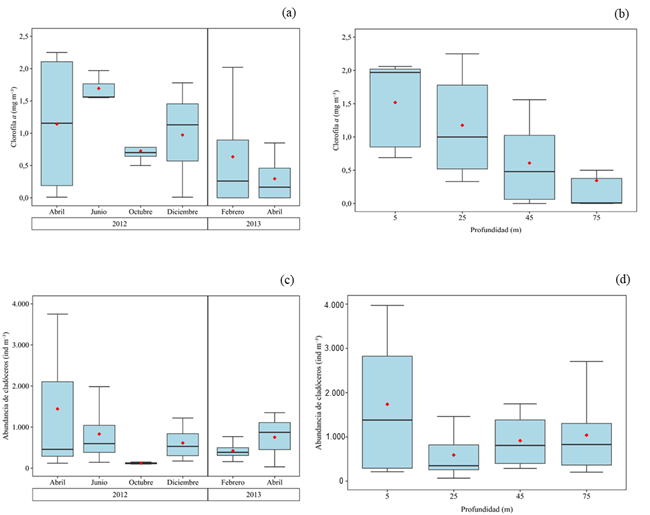
Figura 3.- (a, b) Variación temporal y espacial de la Clorofila a (Chl a) y (c,d) abundancia temporal y espacial de los cladóceros en general en la depresión de Guaracayal, golfo de Cariaco, Venezuela.
Abundancia de los cladóceros
Se contabilizó un total de 46.994 ind.m-3 de cladóceros; detectando los valores más elevados en abril 2012 y 2013 (24.332 y 9.686 ind.m-3, respectivamente); sin embargo, estos valores extremos se eliminaron de la figuras, para una mejor representación de la tendencia general (Fig. 3 c,d). Por consiguiente, se observó la mayor abundancia en abril y junio 2012 (122 -3751 ind.m-3, = 1.444 ind.m-3 y 144 – 1.985 ind.m-3, = 832 ind.m-3 respectivamente), mientras que en octubre 2012 se obtuvo la menor abundancia (102 - 151 ind.m-3, = 122 ind.m-3) de estos organismos. No se detectaron diferencias significativas en abundancia de cladóceros entre los meses ni profundidades (prueba de Kruskal-Wallis, KW = 7,09 y KW= 1,17; p > 0,05; Fig. 3 c,d).
Relación de los cladóceros con la composición zooplanctónica
Cuando los cladóceros se encontraban en su máxima abundancia (abril y junio del 2012 y abril del 2013) constituían porciones importantes dentro del mezozooplancton en la depresión de Guaracayal (Fig. 4), con proporciones entre 40 – 60% del total de la abundancia zooplanctónica. En octubre 2012 y febrero 2013, disminuyó la abundancia, con proporciones entre 20 -25% ocupando un segundo lugar, precedidos por los copépodos quienes fueron los más abundantes durante esos meses.
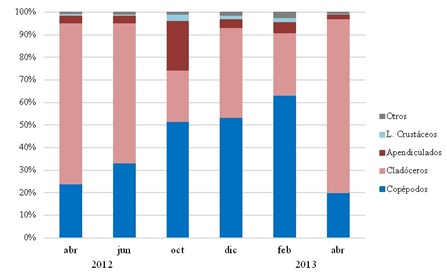
Figura 4.- Composición porcentual de la abundancia zooplanctónica en la depresión de Guaracayal, golfo de Cariaco, Venezuela.
Se identificaron 4 especies de Branchiopoda (Cladocera) pertenecientes a 2 familias y 4 géneros, de las cuales tres de ellas pertenecen a la Familia Polyphemidae y al Orden Onychopoda: Pseudoevadne tergestina Claus, 1877; Evadne spinifera P.E. Müller, 1867 y Pleopis polyphemoides (Leuckart, 1859) y la otra especie, Penilia avirostris (Dana, 1852) corresponde a la Familia Sidiidae y al Orden Ctenopoda. La especie más abundante durante todo el estudio fue P. tergestina, mientras que la menos abundante correspondió a P. polyphemoides.
Distribución temporal y vertical de los cladóceros
Pseudevadne tergestina fue la especie con mayor representación porcentual tanto temporal como en casi todas las profundidades estudiadas (Fig. 5 a,b). En abril y junio 2012 estuvo presente con una abundancia mayor al 50% en casi todas las profundidades analizadas, a excepción de abril a los 75 m donde solamente obtuvo un 20% de abundancia. Luego en octubre y diciembre 2012, registró los mayores porcentajes (97% y 89%, respectivamente) de abundancia de todos los meses estudiados y con una dominancia absoluta en la columna de agua. En febrero 2013 la representación porcentual de esta especie disminuyo con la profundidad, registrando los porcentajes más altos (79%) a 5 m y disminuyendo a los 75 m (45%). En el último mes de muestreo (abril 2013), P. tergestina obtuvo una representación entre 40 - 45% a los 5 y 25 m, en las siguientes profundidades se observó una disminución de la abundancia (5 – 8%; Fig. 5 a,b). Penilia avirostris, segunda especie en orden de abundancia; en abril 2012 obtuvo porcentajes de abundancias del 40% a nivel superficial (5 – 25 m), para luego disminuir con la profundidad (5 – 12%). En junio 2012 a 25 m se alcanzó una abundancia del 80%, mientras en octubre 2012 estuvo ausente a nivel superficial, sin embargo, se registraron porcentajes de abundancias muy bajos (2%) a nivel profundo (45 - 75 m); en diciembre 2012 y febrero 2013 estuvo presente, aunque con mayores porcentajes (10 – 40%) de abundancia por debajo de los 25 m de profundidad. En abril 2013, P. avirostris fue la especie más abundante a nivel profundo (> 45 m), con valores de porcentajes > 80% (Fig. 5 a,b). Evadne spinifera consiguió el tercer lugar en abundancia; se halló en abril, junio, octubre y diciembre 2012, aunque con bajos porcentajes (2 – 8%) de abundancia y casi siempre por encima de los 45 m de profundidad. Sin embargo, es importante destacar la presencia de esta especie en abril 2013 en toda la columna de agua, aunque con un bloom significativo sobre los 25 m de profundidad, con porcentajes de abundancia entre 15 - 30% (Fig. 5a,b). Por último, Pleopis polyphemoides, fue la especie menos abundante; esta especie obtuvo los mayores porcentajes de abundancia en abril 2012 y abril 2013, estando presente en toda la columna de agua, incluso con los mayores porcentajes por debajo de los 45 m de profundidad (Fig. 5a,b).
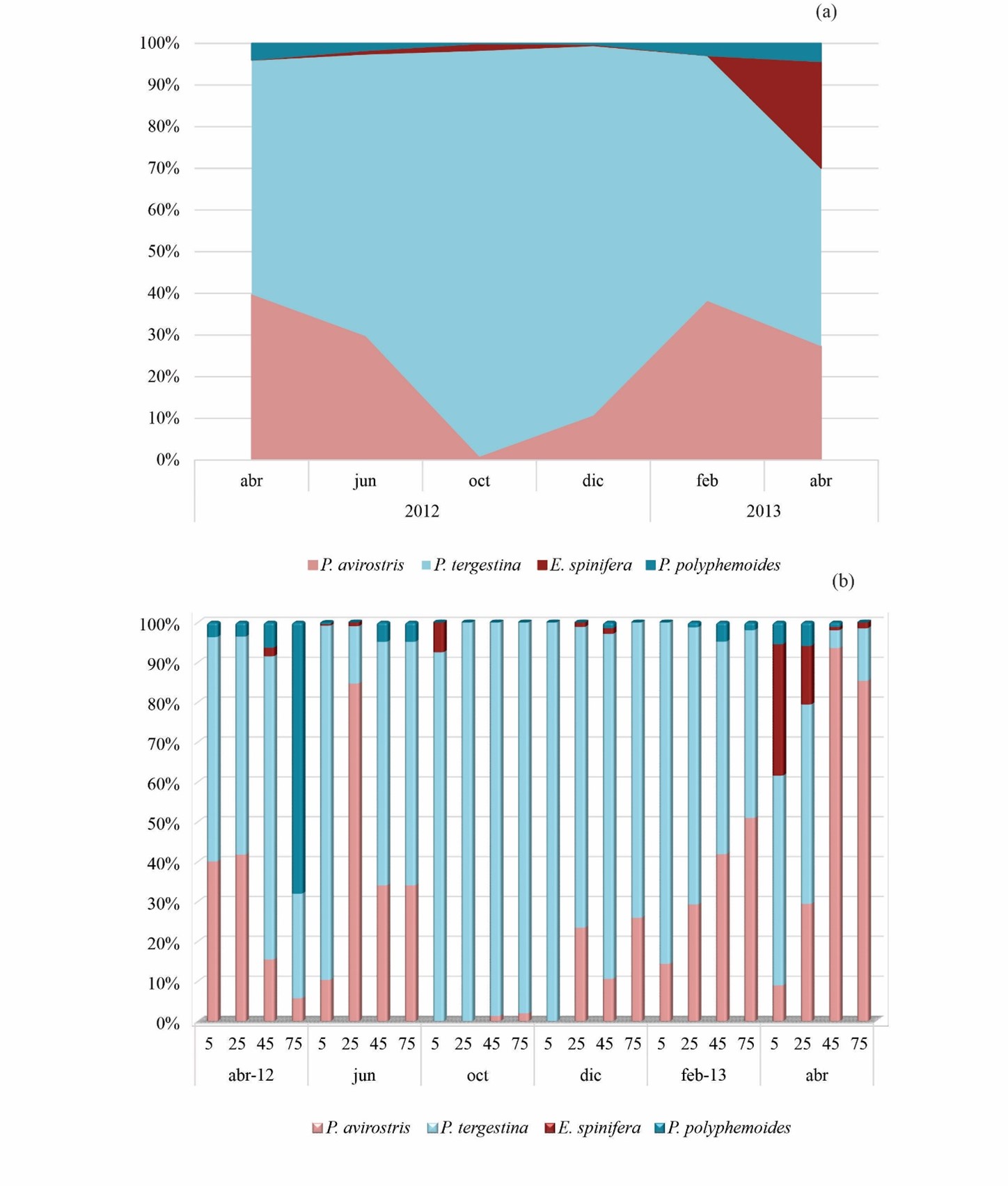
Figura 5. Distribución porcentual de los Cladocera durante los meses (a) y las profundidades (b) estudiadas en la depresión de Guaracayal, golfo de Cariaco, Venezuela.
Las relaciones entre la abundancia total y las especies de cladóceros y los parámetros ambientales examinados mostraron correlaciones positivas entre la abundancia total de los cladóceros y la Clorofila a (prueba de correlación de rangos de Spearman, r= 0,42) y negativa con la salinidad y profundidad (r= -0,32, r= -0,24). P. avirostris exhibió una correlación negativa con la temperatura y oxígeno disuelto (r= -0,66, r= -0,20). Por su parte, P. tergestina mostró correlación positiva con la Clorofila a (r= 0,40) y negativa con la profundidad (r= -0,30). E. spinifera y P. polyphemoides revelaron correlaciones negativas con la salinidad (r= -0,15 y r =-0,67) (Figura 6).
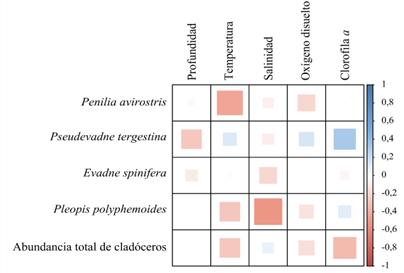
Figura 6.- Correlograma de la abundancia total y de las especies de cladóceros y los parámetros ambientales estudiados en la depresión de Guaracayal, golfo de Cariaco, Venezuela.
DISCUSIÓN
El sureste del Mar Caribe experimenta la influencia de la surgencia costera estacional impulsada por el viento. Se considera que la temporada de afloramiento ocurre entre diciembre y julio, incluso durante el período de temperatura del agua más templada, estas aguas costeras son ~1ºC más frías que en el Caribe central, lo que indica cierto grado de afloramiento durante ese período (Rueda-Roa et al., 2018). Los resultados obtenidos en la presente investigación avalan lo mencionado por los autores anteriores, ya que en febrero 2013 se registró la temperatura más baja, salinidad alta y en octubre 2012 la temperatura más elevada. Sin embargo, hay que destacar que el comportamiento de las masas de agua en los dos años estudiados fue diferente, por ejemplo en abril 2012 la temperatura y la clorofila a reportaron valores más elevados, con mayores concentraciones de oxígeno disuelto, con aguas hipóxicas a los 75 m, a diferencia de abril 2013 donde los valores de temperatura y la clorofila a fueron más bajos e incluso el oxígeno disuelto fue menor, reportando aguas anóxicas en el estrato profundo. Estas diferencias pudieran ser explicadas por cambios estacionales de la intensidad de la surgencia referidos por Taylor et al. (2012) como consecuencia de la variabilidad en el desplazamiento de la Zona de Convergencia Intertropical (ZCIT).
Estos resultados coinciden con el fenómeno de surgencia costera que ocurren en el mismo período en la Cuenca de Cariaco (Márquez-Rojas et al. 2009) y golfo de Cariaco (Martínez et al., 2011; Márquez et al., 2011). Por su parte, Quintero et al. (2004) explican que, debido a la acción de los diferentes parámetros meteorológicos y astronómicos, la temperatura del agua en el mar se incrementa en la superficie y disminuye rápidamente con la profundidad, corroborando la estratificación térmica durante la surgencia en la presente investigación, donde se observan capas de diferente temperatura, siendo más elevada en el estrato superficial (Jury 2017; Rueda-Roa et al., 2018).
En general, la concentración de oxígeno disuelto reportada en el estrato superficial en la depresión de Guaracayal fue normóxica (6,3-8,80 mg L-1) durante los meses de estudio (Okuda et al., 1978). Sin embargo, se demostró la presencia de la zona de mínimo de oxígeno (ZMO) por la estratificación del oxígeno disuelto y la disminución de su concentración con la profundidad, hasta reportar valores bajos (anoxia) por debajo de los 75 m durante la época de relajación, cuando es escasa la ventilación en la columna de agua.
Los cladóceros, por lo general, son vistos como un constituyente secundario del zooplancton marino, ubicándose muy por debajo de los copépodos en cuanto a la densidad poblacional (Marazzo y Valentin, 2004). Sin embargo, en el estudio de Gómez (2019) y Brito (2019) en la costa oriental de la isla de Margarita y la bahía de Mochima, Venezuela, respectivamente, reportaron a los cladóceros como el grupo más abundantes y predominante. No obstante, los Cladocera aumentan el número de sus poblaciones en ciertos meses y a veces muestran abundancias más altas que los copépodos, lo que sugiere que muestran variabilidad estacional. En este estudio, los Cladocera representaron el 60% de la abundancia total del mesozooplancton, superando a los copépodos cuando ocurrieron sus máximas abundancias. Resultados similares fueron encontrados por Kenmochi et al. (2022) en la bahía de Suruga, Japón, donde los cladóceros constituyeron el 87% de abundancia total del mesozooplancton. Estos hallazgos sugieren que la ocurrencia de los cladóceros en la depresión de Guaracayal, es un fenómeno recurrente en términos de su periodicidad y alta abundancia; por lo tanto, el conjunto de Cladocera en esta localidad se caracteriza por ser estacional: picos más altos en surgencia y picos más pequeños en relajación.
Las cuatro especies de cladóceros identificadas en este estudio han sido reportadas previamente en el nororiente de Venezuela (Zoppi y Palacios, 2005; Scott-Frías y Zoppi, 2010; Márquez-Rojas et al., 2006, 2011, 2016; Márquez-Rojas y Zoppi, 2017; Segovia, 2017; Bravo, 2019). Entre ellas, Pseudoevadne tergestina fue la más abundante en la depresión de Guaracayal. Esta especie se caracteriza por aparecer durante la temporada de aguas cálidas o época de relajación (Márquez et al., 2011; Pinedo, 2014). Se observó una correlación positiva entre la abundancia de P. tergestina y la temperatura del agua, pero más fuerte fue la correlación entre las abundancias de esta especie y las concentraciones de clorofila a, probablemente se deban a las altas concentraciones de clorofila a registradas durante la época de relajación, con los valores más elevados de junio a diciembre 2013, cuando esta especie fue más abundante (Fig. 6). Estas elevadas concentraciones de Clorofila a, podrían deberse a que el fitoplancton en la columna de agua muestras sectores de retención y acumulación que dependen de las propiedades biológicas e hidrográficas de la columna de agua (Grangrade y Franks, 2023). No obstante, estos resultados coinciden con Marazzo y Valentin (2004), en la bahía de Guanabara, Brasil, quienes indicaron que esta especie es característica de masas de aguas cálidas. De igual manera, concuerda con Segovia (2017) en la bahía de Mochima, Venezuela, donde menciona que P. tergestina, fue la más abundante y la temperatura desempeño un papel importante en la dinámica de población de estos organismos, registrando abundancias mayores cuando la temperatura aumenta. Por lo tanto, se sugiere que la abundancia de P. tergestina está relacionada con la temperatura del agua. Por consiguiente, este cladócero, pudiera usarse como especie indicadora de masa de agua cálida costera en el oriente del país, tal y como se ha observado en otras partes del mundo (Egloff et al., 1997; Onbé, 1999; Marazzo y Valentin, 2004).
Penilia avirostris fue la segunda especie en orden de abundancia. Estos resultados coinciden con Segovia (2017) en la bahía de Mochima, Venezuela, realizado en época de surgencia. En el presente estudio, esta especie mostró alta abundancia en surgencia cuando estuvo bien representada en toda la columna de agua, incluso fue abundante en la isobata de los 45 y 75 m, tanto en febrero y abril 2013, donde se detectaron aguas con concentraciones < 3 mg. L-1 de oxígeno disuelto en febrero y aguas anóxicas en abril. Sin embargo, estuvo ausente en octubre y en muy bajas densidades en diciembre 2012. P. avirostris es un cladócero cosmopolita frecuente en aguas costeras tropicales y subtropicales (Marazzo y Valentín, 2003a). Es una especie euritermica, pero prefiere principalmente aguas cálidas (Rose et al., 2004). Según Onbé (1974), P. avirostris se encuentra óptimamente en agua con temperatura alrededor de 25°C, aunque puede encontrarse en aguas hasta de 18°C, como sucede en Bahía Magdalena, México (Hernández-Trujillo et a., 2010). Lo mencionado anteriormente coincide con los resultados obtenidos en la depresión de Guaracayal, donde esta especie se ubicó en rangos de temperatura de 19 – 26 °C, sin embargo, sus mayores abundancias se registraron cuando la temperatura osciló entre 19-20°C. Esto también constató la correlación negativa con la temperatura. Además de la temperatura como posible factor ambiental que podría explicar las variaciones de densidad de P. avirostris en la depresión de Guaracayal, estaría el efecto directo de la depredación, por parte de los apendiculados y copépodos carnívoros, los cuales fueron abundantes en octubre y diciembre 2012 (López-Urrutia et al., 2004). Por lo tanto, factores biológicos como la reproducción y la depredación, deben ser atendidos con estudios de dinámica poblacional, de fecundidad y de distribución vertical de cladóceros en el golfo de Cariaco para avanzar en la comprensión de la estructura de la comunidad de zooplancton.
En el presente estudio, la abundancia de P. polyphemoides aumentó en los meses de surgencia (abril 2012 y abril 2013) cuando la temperatura del agua osciló entre 19 y 20°C y la especie no se encontró en los meses de relajación. Esto coincide con los resultados de Marazzo y Valentin (2003b) en una bahía de Río de Janeiro, quienes informaron que las poblaciones de esta especie prosperan principalmente en aguas con temperatura entre 18 y 22 °C. En contraste con las explosiones demográficas periódicas de la especie dominante, el cladócero podónido, Pleopis polyphemoides se detectó ocasionalmente, en pequeñas cantidades, durante los muestreos del estudio. Resultados similares fueron reportados por Marazzo y Valentin (2003b) y Della-Posta y De Arruda-Leme (2015) para Brasil y más recientemente por Kenmochi et al. (2022) para los podónidos P. polyphemoides y Podon leuckartii, en la bahía de Suruga, Japón. Por lo tanto, la temperatura es un factor determinante que influye en la población de P. polyphemoides, tal y como ha sido mencionado por los autores antes mencionado; sin embargo, en este estudio esta especie mostró fuerte correlación negativa con la salinidad. P. polyphemoides es una especie euritermica y eurihalina, frecuentemente asociadas con aguas estuarinas (Onbé, 1999), tal y como se ha observado en Brasil (Marazzo y Valentin, 2003b; Valentin et al., 2003; Miyashita et al., 2011). Así, los valores más bajos de salinidad en nuestra área de estudio pueden explicar las mayores abundancias y frecuencias observadas para esta especie. Por otra parte, la baja abundancia de este podónido, pudiera ser por su pequeño tamaño; estos micro cladóceros pueden pasar a través de la malla de la red de plancton (333 μm) utilizada en este estudio (Basuri et al., 2023); abundancias relativamente bajas también se registraron en muestras con red Norpac con malla de 100 μm (Kenmochi et al., 2022). Aunque no se puede descartar por completo la posibilidad de subestimación de estos cladóceros, se sugiere que nuestros resultados proporcionan una aproximación de la vista general de las abundancias estacionales de las poblaciones de cladóceros del mesozooplancton en el golfo de Cariaco.
Se observó que E. spinifera estuvo presente en grandes cantidades en abril 2013 a nivel superficial (> 25 m), el resto de los meses del estudio estuvo prácticamente ausente. E. spinifera, es de ocurrencia rara y muestra baja abundancia en aguas neríticas, cuando se compara con otras especies de cladóceros. Esto coincide con los resultados de Segovia (2017) y Brito (2019) para la bahía de Mochima, Venezuela, sin embargo, contrasta con lo reportado con Scott-Frías (2011) en la costa norte de Paraguana, Falcón, Venezuela, donde esta especie fue la segunda en abundancia, superando incluso a P. tergestina, indicando además que E. spinifera es una especie característica de aguas oceánicas y con mayor presencia durante periodos de surgencia. Esta especie presentó correlación negativa con la salinidad, coincidiendo su máxima abundancia con el registró de salinidad más bajo a nivel superficial de todo el estudio. Por lo tanto, la fuerte influencia de las aguas costeras de baja salinidad, ya sea de origen continental o estuarina, puede favorecer la supervivencia y reproducción de las comunidades de cladóceros marinos (Kenmochi et al., 2022), en este caso en particular E. spinifera puede ser utilizada como indicador de estas aguas.
Como es bien conocido, la composición y abundancia de las comunidades zooplanctónicas pueden verse influidas por varios factores físicos, químicos y biológicos (Neves et al., 2003). Por su parte, Valentin y Marazzo (2003), Marazzo y Valentin (2004) y Sampaio et al. (2011) indicaron que factores como la salinidad, el oxígeno disuelto y las mareas pueden afectar la ocurrencia y distribución de los cladóceros. Tomando como base lo expuesto anteriormente, se puede deducir que las variables físico-químicas estudiadas jugaron un papel relevante en el ensamblaje de los cladóceros marinos de la depresión de Guaracayal; esto quedó demostrado con la máxima abundancia de P. tergestina en la época de relajación, asociado con temperaturas cálidas (> 25°C) y concentraciones de Clorofila a relativamente altas (1 - 2 mg m-3), mientras que P. avirostris alcanzó sus máximas abundancias en surgencia, con temperaturas bajas (19 – 21 °C) e incluso en la isóbata de 75 m de profundidad con condiciones anóxicas. P. polyphemoides y E. spinifera fueron las menos frecuentes. Las mayores abundancias de P. polyphemoides dependen de la baja temperatura y salinidad, mientras que E. spinifera se asoció únicamente con la salinidad.
Los cladóceros marinos son presa de numerosos animales carnívoros, como los quetognatos (Kehayias y Kourouvakalis, 2010), larvas de peces (Sabatés et al., 2015), y medusas (Barz y Hirche, 2005). Estudios previos realizados en las zonas costeras han confirmado de la importancia de los cladóceros en redes alimentarias marinas y bucles microbianos (Turner et al., 1988; Lipej et al., 1997; Terbıyık-Kurt et al., 2018). Sorprendentemente, los cladóceros marinos han sido poco estudiados, en comparación con los numerosos estudios sobre otros crustáceos planctónicos en el golfo de Cariaco. La importancia de P. tergestina y P. avirostris en la depresión de Guaracayal parece ser subestimada, dadas sus altas densidades y su importante en la trofodinámica, por lo que estudios de dinámica poblacional, de fecundidad y de distribución horizontal y vertical de cladóceros en el golfo de Cariaco son necesarios para avanzar en la comprensión de la estructura de la comunidad de zooplancton.
CONCLUSIÓN
Los resultados de este estudio mostraron cambios estacionales y verticales en la distribución y abundancia de las especies de Cladocera en la depresión de Guaracayal; las variables estudiadas jugaron un papel relevante en el ensamblaje de los Cladocera marinos de esta localidad. A pesar que las especies dominantes coexisten estacional y espacialmente en la zona, éstas responden a factores ambientales diferentes. Así, los incrementos en abundancia de P. tergestina se registraron en la época de relajación, con temperaturas cálidas y elevadas concentraciones de clorofila a. En cambio, las máximas abundancias de P. avirostris se hallaron en surgencia y en los estratos profundos anóxicos. La abundancia de P. polyphemoides se relacionó con los meses de surgencia, colectándose en toda la columna de agua y con fuerte correlación negativa con la salinidad. E. spinifera se asoció únicamente con la salinidad, por lo que las mayores abundancias dependen de la baja salinidad en el estrato superficial. Los hallazgos de este estudio podrían servir como referencia para futuros estudios. En este sentido, se deben realizar estudios en áreas más amplias con períodos de muestreo más frecuentes, los cuales serían beneficiosos para determinar cambios en la población de estos organismos.
LITERATURA CITADA
Audemard, F., Moernaut, J., De Rycker, K., De Batist, M., Sánchez, J., González, M., Sánchez, C., Versteeg, W., Malavé, G., Schmitz, M., Carrillo, E., y Lemus, A. (2007). La depresión submarina de Guaracayal, estado Sucre, Venezuela: Una barrera para la propagación de la ruptura cosísmica a lo largo de la falla del Pilar. Interciencia 32, 735-741.
Basuri, C. K., Garlapati, D., Chandrasekaran, M., Karri, R. and Ramanamurthy M. V. (2023). Influence of environmental heterogeneity on the distribution of micro-zooplankton community along the tropical coastal waters. Mar Pollut Bull. doi: 10.1016/j.marpolbul.2023.115546.
Barz, K. y Hirche, H. J. (2005). Seasonal development of scyphozoan medusae and the predatory impact of Aurelia aurita on the zooplankton community in the Bornholm Basin (central Baltic Sea). Mar. Biol. 147, 465–476.
Bonilla, R., Senior, W., Bugden, J., Safino, O., y Tones, R. (1993). Seasonal distribution of the nutrients and primary productivity in the eastern Caribbean as the influence by the Orinoco River. J. Geophys. Res. 98, 2245-2259.
Bravo, F. (2019). Composición, abundancia y distribución de los Branchiopoda (Cladóceros) marinos del Parque Nacional Mochima, estado Sucre, Venezuela. Trab. Grad. Lic Biología Departamento de Biología, Universidad de Oriente. Cumaná, Venezuela.
Casanova, E., Zoppi De Roa, E., y Montiel, E. (2007). Caracterización espacial y temporal del zooplancton en el Archipiélago Los Roques, Venezuela. Bol. Inst. Oceanogr. Venez, 46(1), 51-65.
Caraballo, M. (1982). El golfo de Cariaco. Parte I. Morfología y Batometría. Estructura y tectonismo reciente. Bol. Inst. Oceanogr. Venez, 21(1-2), 13-35.
Della-Posta, R. y De Arruda-Leme, M. H. (2015). Variação temporal de cladóceros marinhos em uma região estuarina de Ubatuba, SP, Brasil. Boletim do Instituto Pesca, São Paulo, 41(2): 327–334.
Dodson, S. L., Cáceres, C. E., y Rogers, D. C. (2010). Cladocera and other Branchiopoda. En J. H. Thorp y A. P. Covich (Eds.), Ecology and classification of North American freshwater invertebrates (pp. 773–827). Academic Press.
Egloff, D. A., Fofonoff, A. W., y Onbé, T. (1997). Reproductive biology of marine cladocerans. Adv Mar Biol, 31, 79–167
Forró, L., Korovchinsky, N. M., Kotov, A. A., y Petrusek, A. (2008). Global diversity of cladocerans (Cladocera; Crustacea) in freshwater. Hydrobiologia, 595: 177–184.
Fryer, G. (1987). Morphology and the classification of the so-called Cladocera. Hydrobiologia, 145, 19–28. https://doi.org/10.1007/BF02530261
Gómez, A. (2019). Variación a largo término (2002-2016) en la densidad y composición del mesozooplancton indica cambio de régimen en isla Margarita (Venezuela). Boletín de Investigaciones Marinas y Costeras, 48 (1): 65-87
Gómez, A. y Hernández, I. (2008). Abundancia interanual del zooplancton nocturno en la costa este de Isla Margarita, Venezuela. Bol. Inst. Oceanogr. Venez, 47(2), 91-102.
Gangrade, S. y Franks, P. J. (2023). Phytoplankton patches at oceanic fronts are linked to coastal upwelling pulses: Observations and implications in the California Current System. Journal of Geophysical Research: Oceans, 128(3), e2022JC019095.
Guerrero, R., Hernández, N., Morales, F., López, C., y Montiel, M. (2016). Primer reporte de los Cladóceros Penilia avirostris y Pseudevadne tergestina en la boca San Carlos-Zapara del Sistema de Maracaibo, estado Zulia. Ciencia, 24(1), 5-14.
Hernández-Trujillo, S., Esqueda-Escárcega, G., Hernández-Alfonso, J. R y Pacheco-Chávez, R. (2010). Variación diaria de la abundancia del zooplancton en Bahía Magdalena, B.C.S. México. Revista Mexicana de Biodiversidad, 81: 913- 920.
Jury, M. R. (2017). Eastern Venezuela coastal upwelling in context of regional weather and climate variability. Regional Studies in Marine Science 18, 219-228.
Kehayias, G., y Kourouvakalis, D. (2010). Diel vertical migration and feeding of chaetognaths in coastal waters of the eastern Mediterranean. Biologia 65, 301–308.
Kenmochi, A., Takahashi, D., Matsuura, H., Yoshikawa, T., Sohrin, R., & Obayashi, Y., Kuroda, H., y Nishikawa, H. (2022). Cladoceran communities in offshore Suruga Bay, Japan: How are they formed?. Journal of Oceanography, 79, 1-11. 10.1007/s10872-022-00662-5.
Killi, N. (2020). Spatio-temporal variation in the distribution and abundance of marine cladocerans in relation to environmental factors in a productive lagoon (Güllük Bay, SW Aegean Sea, Turkey). Oceanol. Hydrobiol. Stud. 49(4), 374-382.
Lipej, L., Mozetic, P., Turk, V. y Malej, A. (1997). The trophic role of the marine cladoceran Penilia avirostris in the Gulf of Trieste. Hydrobiologia 360, 197–203.
Lopes, V. G., Castelo Branco, C. W., Kozlowsky-Suzuki, B., Sousa-Filho, I. F., Souza, L. C. E., and Bini, L. M. (2017). Predicting temporal variation in zooplankton beta diversity is challenging. PLoS One, 12(11), e0187499.
López-Urrutia, Á., Roger, A. P. and Smith, T. (2004). Predation by calanoid copepods on the appendicularian Oikopleura dioica, Limnology and Oceanography, 1, doi: 10.4319/lo.2004.49.1.0303.
Lorenzen, C. J. (1967). Determination of chlorophyll and phaeopigments: spectrophotometric equations. Limnol. Oceanogr. 12, 343-346.
Marazzo, A., y Valentin, J. L. (2000). Daily variation of marine cladoceran densities in a tropical bay-Brazil. Hydrobiologia 428, 205–208.
Marazzo, A. y Valentin, J. L. (2001). Spatial and temporal variations of Penilia avirostris and Evadne tergestina (Crustacea, Branchiopoda) in a tropical bay, Brazil. Hydrobiologia, 445, 133-139.
Marazzo, A. y Valentin, J. L. (2003a). Population dynamics of Penilia avirostris (Dana, 1852) (Cladocera) in a tropical bay. Crustaceana 76, 803–817.
Marazzo, A. y Valentin, J. L. (2003b). Population parameters of Pleopis polyphemoides (Crustacea, Cladocera) in a tropical bay, Estuarine, Coastal and Shelf Science, 57 (5–6): 1015-1021. https://doi.org/10.1016/S0272-7714(03)00007-6.
Marazzo, A. y Valentin, J. L. (2004). Reproductive aspects of marine cladocerans Penilia avirostris and Pseudevadne tergestina (Crustacea, Branchiopoda) in the outer part of Guanabara Bay, Brazil. Braz. J. Biol, 64(3), 543-549. http://dx.doi.org/10.1590/S1519- 69842004000300017. PMid:15622851
Márquez, A., Senior, W., Benítez, A., Fermín, I., Martínez, G., González, A., Castañeda, J., Alcalá, L., y De La Cruz, R. (2011). Sector oriental del golfo de Cariaco, Venezuela. Una descripción de su dinámica hidroquímica, procesos, y del rol de la surgencia costera estacional. Bol. Inst. Oceanogr. Venez, 50(2), 255-272.
Márquez-Rojas, B., Marín, B., Zoppi, E. y Moreno, C. (2006). Zooplancton del golfo de Cariaco. Bol. Inst. Oceanogr. Venez, 45(1), 61-78.
Márquez-Rojas, B., Díaz-Ramos, J., Troccoli, L., Marín, B. y Varela, R. (2009). Densidad, biomasa y composición del zooplancton, en el estrato superficial de la cuenca de Cariaco, Venezuela. Rev. Biol. Mar. Oceanogr. 44(3), 737-749
Márquez-Rojas, B., Troccoli, L., Marcano, L., Morales, J., Allen, T., Marín, B. y Díaz, R. (2011). Estructura comunitaria del zooplancton en dos localidades del golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez 45(1), 61-78.
Márquez-Rojas, B., Benítez-Brito, M. y Troccoli, L. (2016). Hidrografía y cambios estructurales del mesozooplancton en el golfo de Cariaco, en dos períodos contrastantes. Rev. Biodivers. Neotrop, 6(2), 135-46.
Márquez-Rojas, B. y Zoppi, E. (2017). Zooplancton de la Bahía de Mochima: retrospectiva y prospectiva. Saber, 29, 495-511.
Martínez, G., Hernández, D., Quintero, A., Márquez, A., Senior, W. y González, A. (2011). Estudio físico-químico de las aguas del sector oriental del golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez. 50(2): 273-287.
Miyashita, L.K., Gaeta, S. A. y Lopes, R. M. (2001). Life cycle and reproductive traits of marine podonids (Cladocera, Onychopoda) in a coastal subtropical area. Journal of Plankton Research. 33(5): 779-792.
Monteiro-Ribas, W. M., Freitas, I. S. y Rosa, J. C. (2013). Record of Pleopis schmackeri (Poppe) Branchiopoda in Rio das Ostras, Rio de Janeiro, Brazil. Biotemas, 64(2), 149-156. http://dx.doi.org/10.5007/2175-7925.2013v26n1p201
Neves, I., Rocha, O., Roche, K. y Pinto, A. (2003). Zooplankton community structure of two marginal lakes of the River Cuiabá (Mato Grosso, Brazil) with analysis of Rotifera and Cladocera diversity. Braz. J. Biol. 63(2), 329-343.
Okuda, T., Álvarez, J., Bonilla, J. y Cedeño, G. (1978). Características hidrográficas del golfo de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez, 17(1-2), 69-88.
Onbé, T. (1974). Studies on the ecology of marine cladocerans. J Fac Fish Anim Husb Hiroshima Univ 13, 88–179.
Onbé T. (1999). Ctenopoda and Onychopoda (=Cladocera). En Boltovskoy, D. (ed). South Atlantic Zooplankton (pp. 797–811). Backhuys Publishers, Leiden.
Onbé, T., Terazaki, M., y Nagasawa, S. (1996). Summer distribution of marine cladocerans in Otsuchi Bay, northeastern Honshu, Japan. Bull Plankton Soc Japan, 43,121–131.
Paggi, J. C. (2004). Importancia de la fauna de “Cladoceros” (Crustacea, Brachiopoda) del Litoral Fluvial Argentino. INSUGEO, 12, 5-12
Parsons, T., Maita, Y., y Lalli, C. (1984). A manual of chemical and biological methods of seawater analysis. Pergamon Press, Oxford.
Pinedo, E. (2014). Estructura comunitaria del zooplancton de la costa peruana asociado a las masas de agua durante los veranos del 2000 y 2003. Trab. Grado. Lic. Biología mención zoología. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima, Perú.
Postel, L., Fock, H., y Hagen, W. (2000). Biomass and abundance. En: R. P. Harris, P. H. Wiebe, J. Lenz, H. R. Skjoldal y M. Huntley (Eds.). ICES Zooplankton Methodology Manual (pp. 83-174). Academic Press, San Diego.
Quintero, A., Terejova, G., Vicent, G., Padrón, A. y Bonilla, J. (2002). Los pescadores del golfo de Cariaco. Interciencia, 27(6), 286-292.
Quintero, A., Bonilla, J., Serrano, L., Amaro, M., Rodríguez, B., Terejova, G. y Figueroa, Y. (2004). Características ambientales de la bahía de Mochima y adyacencias de la cuenca de Cariaco, Venezuela. Bol. Inst. Oceanogr. Venez, 43 (1 y 2), 49-64.
Ramírez, F. C. (1981). Cladocera. En: D. Boltovskoy (Ed.), Atlas del Zooplancton del Atlántico Sudoccidental y métodos de trabajo con el zooplancton marino (pp. 538-542). Mar del Plata: INIDEP.
Ramírez, F. C. (1996). Introducción al estudio del zooplancton marino. En: R. Gasca y E. Suárez (Eds.), Cladocera (pp. 191-211). El Colegio de la Frontera Sur (ECOSUR)/CONACYT. Chetumal, México.
R Core Team. (2016). R: a language and environment for statiscal computing. R Foundation for Statistical Computing. Vienna. Austria. Disponible en: https://www.R-project.org/. (revisada agosto 2023).
Rosa, J. C., Batistac, L. L. y Monteiro-Ribas, W. M. (2022). Spatio-temporal variability in the Cladocera assemblage of a subtropical hypersaline lagoon. Brazilian Journal of Biology, 2022, vol. 82, e236354 | https://doi.org/10.1590/1519-6984.236354
Rose, K., Roff, J. C. y Hopcroft, R. R. (2004). Production of Penilia avirostris in Kingston Harbour, Jamaica. J. Plankton Res. 26(6), 605-615. http://dx.doi.org/10.1093/plankt/fbh059.
Rueda-Roa, D. T., Ezer, T., y Müller-Karger, F. F. (2018). Description and mechanisms of the mid-year upwelling in the Southern Caribbean Sea from remote sensing and local data. J. Mar. Sci. Eng. 6, 36. <doi:10.3390/jmse6020036>
Sabatés, A., Zaragoza, N., y Raya, V. (2015). Distribution and feeding dynamics of larval red mullet (Mullus barbatus) in the NW Mediterranean: the important role of cladocera. J Plankton Res, 37, 820–833.
Sala, J., García-de-Lomas, L. y Alonso, M. A. (2015). Orden Ctenopoda. Revista IDE@-SEA, 69, 1-7. http://www.sea-entomologia.org/IDE@.
Sampaio, C., Mafalda, P., Soluna, J., Ramírez, T., Cortés, D., García, A., Mercado, J. y Vargas, M. (2011). Seasonal changes in the distribution and abundance of marine cladocerans of the Northwest Alboran Sea (Western Mediterranean), Spain. Braz. Arch. Biol. Technol. 54(3), 543-550.
Scott-Frías, J. (2011). Estructura poblacional de las especies planctónicas de ostrácodos y cladóceros (Crustacea) en la costa noroeste de Paraguaná (Falcón, Venezuela). Trab. Grad. Lic Biología, Universidad Central de Venezuela, Caracas, Venezuela.
Scott-Frías, J. y Zoppi, E. (2010). Primer registro de huevo de resistencia en Penilia avirostris (Crustacea: Ctenopoda: Sididae) para aguas costeras venezolanas. Bol. Inst. Oceanogr. Venez, 49(2), 103-107.
Segovia, D. C. (2017). Copépodos y cladóceros (Crustacea) en época de surgencia de la bahía de Mochima (Edo. Sucre). Trab. Grad. Lic Biología, Universidad Central de Venezuela, Caracas, Venezuela.
Sergeeva, N. G., and Gulin, M. B. (2007). Meiobenthos from an active methane seepage area in the NW Black Sea. Marine Ecology, 28(1): 152-159.
Sommer, U. y Sommer, F. (2006). Cladocerans versus copepods: the cause of contrasting top-down controls on freshwater and marine phytoplankton. Oecologia, 147(2), 183-194. http://dx.doi.org/10.1007/s00442-005-0320-0.
Valentin, J. y Marazzo, A. (2003). Modeling the population dynamics of Penilia avirostris (Branchiopoda, Ctenopoda) in a tropical bay. Acta Oecol. 24, 369-376.
Valentin, J. L., Marazzo, A. y Gomes, C. L. (2003). The diel vertical migration pattern of the cladoceran Pleopis polyphemoides (Leuckart, 1859) in a stratified tropical bay. Crustaceana, 76, 513–521.
Taylor, G. T., Muller-Karger, F., Thunell, R. C., Scranton, M. I., Astor, Y., Varela, R. and Doherty, O. (2012). Ecosystem responses in the southern Caribbean Sea to global climate change. PNAS USA 109(47), 19315-19320.
Terbiyik-Kurt, T., y Polat, S. (2014). Characterization of seasonal and inter-annual changes in the abundance of species of marine Cladocera on the Turkish coast of the northeastern Levantine Basin. Crustaceana 87, 769–783.
Terbıyık-Kurt, T., Toklu-Alıçlı, B. y Polat, S. (2018). A Spatial and Temporal Distribution of Marine Cladoceran Species in the Surface Waters of Iskenderun Bay. Aquatic Research 1(2), 77–85. DOI: 10.3153/AR18009.
Turner, J. T., Tester, P. A., y Ferguson, R. L. (1988). The marine cladoceran Penilia avirostris and the “microbial loop” of pelagic food webs. Limnol Oceanogr 32, 245–255.
Verity, P. G. y Smetacek, V. (1996). Organism life cycles, predation, and the structure of marine pelagic ecosystems. Mar. Ecol. Prog. Ser. 130, 277–293.
Wiedenhöfer, H. (1993). Pruebas no paramétricas para las ciencias agropecuarias (muestras pequeñas). FONAIP-Centro Nacional de Investigaciones Agropecuarias. Serie A. Maracay, Venezuela.
Wooldridge, T. H. y Deyzel, S. H. (2009). Temperature and salinity as abiotic drivers of zooplankton community dynamics in the Great Berg Estuary. Trans. R. Soc. S. Afr. 64(2), 219-237. http://dx.doi.org/10.1080/00359190909519254
Zar, J. (1996). Biostatistical analysis. Prentice Hall, Upper Saddle River.
Zoppi, E. y Palacios, M. (2005). Frente Atlántico venezolano. Investigaciones Geoambientales: Ciencias Ambientales. En: M. Gómez, M. Capaldo, C. Yanes y A. Martín (Eds.). Evaluación preliminar de la comunidad zooplanctónica del Frente Atlántico de Venezuela (pp. 127-140). Tomo I. Fondo Editorial Fundambiente, Petróleos de Venezuela, S.A. (PDVSA). Caracas, Venezuela.
BIODATA
Wendy Bernal: Departamento de Biología. Escuela de Ciencias, Universidad de Oriente, Venezuela.
Brightdoom Márquez-Rojas: Laboratorio Zooplancton, Departamento Biología Marina, Instituto Oceanográfico de Venezuela, Universidad de Oriente, Sucre, Venezuela. Profesora e investigadora en Ecología y Taxonomía del zooplancton marino. Licenciada en Biología por la Universidad de Oriente (UDO), con una maestría en Ciencias Marinas del Instituto Oceanográfico de Venezuela, de la Universidad de Oriente. Doctora en Ecología en el Instituto de Zoología y Ecología Tropical de la Universidad Central de Venezuela (UCV). Profesora e investigadora en la Universidad de Oriente de las cátedras de pregrado, postgrado y doctorado: Biología Marina y Taxonomía y ecología del zooplancton. Editora Jefe del Boletín del Instituto Oceanográfico de Venezuela (2018-presente). He realizado múltiples consultorías en estudios de impacto ambiental, plancton y zooplancton. Publicaciones recientes: Literature-based occurrences data of marine species in Venezuela. Biodiversity Data Journal. (https://doi.org/10.3897/BDJ.11.e98213). (2021). Bloom algal y abundancia de copépodos en el golfo de Cariaco, Venezuela (Caribe Suroriental). Intropica (10.21676/23897864.4010).
Luis Troccoli: Instituto de Investigaciones Científicas, Facultad de Ciencias del Mar, Universidad de Oriente, Núcleo Nueva Esparta, Venezuela. Publicaciones recientes: (2023). Fatty acid contribution of microalgal diets on spat performance of the tropical mangrove oyster Crassostrea rhizophorae, in Mochima Bay, Venezuela. Regional Studies in Marine Science. (10.1016/j.rsma.2023.102994). (2022). Performance of the Winged Pearl Oyster Pteria sterna (Gould, 1851), Maintained in Hanging Culture at Three Depths, in the Eastern Equatorial Pacific. Aquaculture Studies. (10.4194/AQUAST926).
Josefa Morales: Centro Nacional de Investigación de Pesca y Acuicultura (CENIPA), Cumana, Sucre, Venezuela.