
PRODUCCION PRIMARIA DEL FITOPLANCTON EN LA LAGUNA BUENAVISTA, MANAURE – LA GUAJIRA (CARIBE COLOMBIANO)
Primary production of phytoplankton in Buenavista lagoon, Manaure - La Guajira (Colombian Caribbean)
RESUMEN
La laguna Buenavista, ubicada en La Guajira, Colombia, fue estudiada para analizar sus características fisicoquímicas y la producción primaria fitoplanctónica. Se midieron parámetros como pH (8,6-8,8), salinidad (34-36 ups), oxígeno (5,5-8 mg·L-1), nutrientes (nitratos de 0,49-1,5 μg·L-1; fosfatos de 1,6-5,1 μg·L-1) y temperatura (26-27°C) en dos estaciones de muestreo. La laguna presentó condiciones típicas de un estuario tropical, con somera profundidad (35-37 cm) y baja transparencia (capa fótica de 12-16 cm). Los nutrientes registraron niveles elevados, indicando la acumulación de los aportes del río Ranchería, comportándose la laguna como reservorio. La producción primaria neta (PPN) fue alta en ambas estaciones, con valores de 1,7-2,6 gC·m-2·d-1, relacionada con la disponibilidad de nutrientes. La producción primaria bruta (PPB) mostró diferencias significativas entre estaciones según la prueba U de Mann-Whitney, con valores de 2,5-3,4 gC·m-2·d-1, sugiriendo un excedente de producción. La respiración fue menor que la PPN. El balance metabólico autotrófico y los altos niveles de PPN evidencian la función ecológica de la laguna como fuente de nutrientes. Se concluye que la Laguna Buenavista presenta condiciones fisicoquímicas adecuadas y una alta producción fitoplanctónica.
Palabras clave: Variables fisicoquímicas, Nutrientes, Metabolismo autotrófico, Salud del ecosistema.
ABSTRACT
Buenavista Lagoon, located in La Guajira, Colombia, was studied to analyze its physicochemical characteristics and phytoplankton primary production. Parameters such as pH (8.6-8.8), salinity (34-36 psu), oxygen (5.5-8 mg L-1), nutrients (nitrates from 0.49-1.5 μg·L-1; phosphates from 1.6-5.1 μg·L-1) and temperature (26-27°C) were measured at two sampling stations. The lagoon exhibited typical tropical estuary conditions, with shallow depth (35-37 cm) and low transparency (photic zone 12-16 cm). Nutrient levels were high, indicating accumulation of Ranchería river´s contributions, with the lagoon acting as a reservoir. Net primary production (NPP) was high at both stations, with values from 1.7-2.6 gC·m-2·d-1, related to nutrient availability. Gross primary production (GPP) showed significant differences between stations according to the Mann-Whitney U test, with values from 2.5-3.4 gC·m-2·d-1, suggesting a production surplus. Respiration was lower than NPP. The autotrophic metabolic balance and high NPP levels evidence the ecological role of the lagoon as a nutrient source, increasing coastal productivity. It is concluded that Buenavista Lagoon presents adequate physicochemical conditions and high phytoplankton production, playing a valuable role in regional fertility.
Keywords: Physicochemical variables, Nutrients, Autotrophic metabolism, Ecosystem health.
INTRODUCCIÓN
La producción primaria fitoplanctónica (PPF) se refiere a la medida en la que el carbono inorgánico es fijado y transformado en materia orgánica por organismos fotosintéticos, utilizando la fotosíntesis para captar energía lumínica y producir moléculas orgánicas aprovechables (Odum,1972; Roldán & Ramírez, 2008). La PPF constituye una entrada de energía al ecosistema, que, al ser transformada en materia orgánica, puede ser transportada a través de los distintos niveles de las redes tróficas de un organismo a otro (Ramírez & Alcaráz, 2002; Hernández, 2017). Adicionalmente la PPF contribuye a desacelerar el calentamiento global por medio de la fijación de CO2, lo cual es de interés para los científicos ya que actualmente es importante realizar estudios con el fin de estimar cuanto y como se transforma en materia orgánica el carbono inorgánico disuelto (CID) (Barocio et al.,2007).
En los ecosistemas estuarinos la PPF depende de diversos factores que en conjunto determinan su disminución y el aumento, siendo los componentes biológicos (biomasa de fitoplancton y pastoreo), físicos (viento, temperatura, radiación solar) y químicos (nutrientes disueltos), de gran importancia (Cloern, 1996). Dichos factores fisicoquímicos son controlados por las interacciones entre el océano, el suelo del fondo del estuario y de los aportes fluviales que transportan materia orgánica, a su vez la dominancia de estas interacciones está determinada por los periodos climáticos que ocurren anualmente (Smith & Hollibaugh, 1997; Hopkinson & Smith, 2005; Gutiérrez et al.,2006). Es así como la variabilidad de los aportes de agua dulce y salada controlan los valores de salinidad dentro de un estuario (Gutiérrez et al.,2006), la energía mecánica proporcionada por las mareas rompe la estratificación del cuerpo de agua y resuspenden los sedimentos, en consecuencia, la entrada de luz es afectada, favoreciendo PPF con la dispersión de nutrientes y microrganismos en la columna de agua (Hernández & Gocke,1990; Cloern et al., 2014). Por otra parte, la radiación solar y los cambios de temperatura tienen efectos reguladores sobre la productividad primaria del fitoplancton en los estuarios (Eppley, 1972; Cloern et al., 2005). Es fundamental mantener un equilibrio entre las condiciones que favorecen e inhiben la PPF en los estuarios, evitando alteraciones tróficas y problemas como la eutrofización (Smith & Hollibaugh, 1997). Igualmente, la intervención humana, como la extracción excesiva de recursos, la alteración del flujo de los afluentes de agua dulce y salada y la contaminación por vertimientos de aguas residuales, también puede afectar negativamente la integridad ecológica de los estuarios (Vollenweider et al., 1974; Botero & Mancera, 1996).
Los ecosistemas acuáticos costeros tropicales son conocidos por su alta productividad y su importancia para diversas especies tanto desde el punto de vista ecológico como comercial (Knoppers, 1994; Botero & Mancera, 1996; Cloern et al., 2014). Sin embargo, los ecosistemas estuarinos tropicales han sido subestimados y en consecuencia han recibido poca atención en términos de investigación (Cloern et al., 2014; Soria-Píriz et al., 2017; Navas et al., 2020). Un ejemplo de esta falta de estudio se puede observar en La Guajira, donde no existen publicaciones sobre la producción primaria fitoplanctónica de los humedales costeros. En contraste, en el Caribe colombiano, se ha llevado a cabo una extensa investigación sobre la producción primaria en la Ciénaga Grande de Santa Marta (CGSM), un sistema lagunar estuarino de gran extensión (Hernández & Gocke, 1990; Sánchez & Zea, 2000; Gocke et al., 2003; Rodríguez-Chila et al., 2009; Granados et al., 2011; Hernández, 2017).
Entre los estudios realizados en la CGSM, se destacan las investigaciones Hernández & Gocke (1990), quienes realizaron un análisis de la PPF, encontrando que la PPN en un año tenía un valor promedio de 990 gC m2, lo cual indicó el carácter autotrófico de la CGSM en el momento del estudio. Granados et al. (2011) encontraron que durante la época de lluvias cuando aumenta el aporte de agua dulce a la CGSM, los valores de salinidad disminuyen en proporción inversa a las concentraciones de nutrientes (amonio, nitritos y fosfatos). Además, observaron que la respiración superó a la producción primaria fitoplanctónica, con un valor máximo de producción primaria neta (PPN) de 1,5 gC m-2d-1. Rodríguez-Chila et al. (2009) señalaron que en 2005 la recomunicación del delta del rio Magdalena con la ciénaga de Pajaral (CP), produjo una PPN de 982 gC m-2·año, mientras que para el año 1989 la PPN tenía un valor de 598 gC m-2· año, por lo cual concluyen que la recomunicación de la Cienaga de Pajarales con el delta del río Magdalena causó cambios en la red trófica ya que aumentaron la PPF y R por los aportes de nutrientes y sedimentos. Por otro lado, Hernández (2017) evaluó los efectos del caño Aguas Negras en la ciénaga de Pajaral y encontró que la PPN máxima fue de 10,19 gC m-2d-1 en octubre de 1999, mientras que la mínima fue de 0,18 gC m-2d-1 en junio de 2000. En ese estudio, la turbidez del agua, la concentración de clorofila y la densidad del fitoplancton indicaron que la tasa de respiración era superior a la fotosíntesis, lo que sugiere un estado de eutrofización en la ciénaga de Pajaral.
Estos estudios resaltan la importancia de examinar el estado de la producción primaria fitoplanctónica en los sistemas acuáticos estuarinos, especialmente aquellos que han sido poco estudiados, como los de La Guajira. Por tanto, el presente trabajo tiene como objetivo analizar las variables fisicoquímicas y la producción primaria del fitoplancton en la Laguna Buenavista. Este análisis ofrece un aporte significativo al estado del conocimiento de las lagunas costeras en la región. A medida que se examinan las variables fisicoquímicas, como la temperatura, la salinidad, los niveles de nutrientes y otros factores ambientales clave, se obtendrá una comprensión más profunda de los procesos que influyen en la dinámica de la laguna, por último, este trabajo contribuirá a un mejor manejo y conservación de los ecosistemas acuáticos costeros al proporcionar información esencial para la toma de decisiones informadas y la implementación de estrategias de preservación adecuadas.
MATERIALES Y MÉTODOS
Área de estudio
La laguna Buenavista, ubicada en La Guajira (Caribe Colombiano), es un humedal costero que forma parte de las 32 lagunas costeras en la región (Riccerca, 2002). Por sus características geomorfológicas, se clasifica como un estuario de planicies costeras con régimen acuático permanente, y su salinidad lo define como un cuerpo de agua mixohalino-euhalino (Corpoguajira e INVEMAR, 2012). Este sistema estuarino se encuentra en el municipio de Manaure, en las coordenadas 11°34'55" N y 72°52'05" W, a nivel del mar, y abarca una extensión de 6,4 km2. La laguna recibe aportes de agua provenientes del río Ranchería, ya que está ubicada en su delta (Gil et al., 2009; Rangel & Anfuso, 2012). La conexión con el mar se realiza a través de canales que permiten el flujo constante de agua cargada de nutrientes. La temperatura promedio en esta zona oscila entre 27-30°C, con picos máximos que pueden alcanzar los 45°C, mientras que la radiación solar supera los 6,0 kWh·m2 día (Vanegas et al., 2015). Es importante destacar que la laguna Buenavista es una fuente de sustento para las comunidades indígenas Wayuu que habitan en sus alrededores. Estas comunidades realizan actividades de pesca para consumo y venta, que son vitales para su subsistencia (Rozo, 2006).
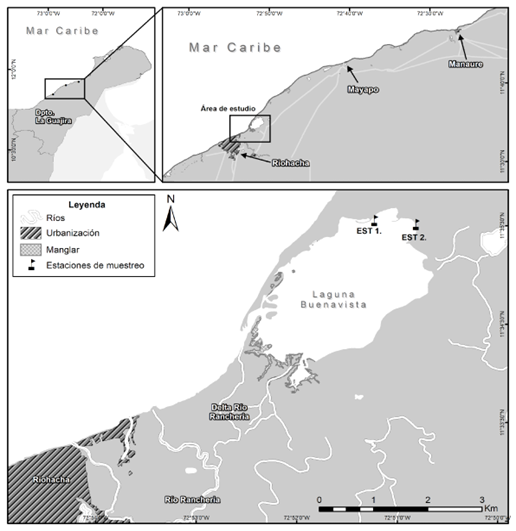
Figura 1 . Localización de las estaciones de muestreo en el área de estudio, ubicada en Buenavista, Manaure, La Guajira.
Variables fisicoquímicas
Se utilizaron diferentes instrumentos para determinar las características del agua en el estudio. El contenido de salinidad se evaluó mediante el uso de un conductímetro WTWLF-98, mientras que el pH se midió con la sonda WTW-pH-98. La temperatura y el oxígeno disuelto se registraron utilizando la sonda WTW-Oxi-98. Además, se tomaron medidas de la profundidad del disco Secchi y la profundidad de la columna de agua. El muestreo se realizó en frascos de plástico previamente enjuagados con agua destilada y etiquetados con información de fecha, hora y localización. Se tomaron muestras de la superficie en recipientes de polietileno de 600 ml, sumergiendo directamente los frascos hasta una profundidad de 20 cm. Las muestras se recolectaron con guantes de nitrilo, enjuagando los frascos con agua de muestreo antes de llenarlos completamente sin dejar espacio de aire. Éstas se preservaron en una nevera portátil a 4°C para su traslado. Para determinar las concentraciones de nutrientes (NH4+, N02–, N03– P04=), se siguieron los procedimientos descritos en Gocke (1987) y APHA (1998). Se emplearon celdas de 1 cm en un espectrofotómetro Spectronic 20 Genesys.
Producción primaria y respiración pelágica
La recolección de datos se realizó durante la primera semana de mayo, la cual corresponde a una época seca típica del primer semestre del año 2016. para determinar las estaciones de muestreo se tuvieron en cuenta los puntos de fácil acceso al interior de la Laguna, estableciendo así dos puntos de muestreo representativos en la investigación (ver Figura 1). Para la toma de las muestras de agua se utilizaron botellones de 20 L; Luego de tomadas las muestras de agua se realizó la medición del oxígeno inicial. Para la determinación de la producción primaria fitoplanctónica se utilizó el método de botellas claras y oscuras (Vollenweider, 1974; Wetzel & Likens, 1991). De los botellones de 20 L se envaso el agua recolectada en botellas Winkler de 100 ml, y se dividieron en tres grupos de 6 unidades, cada uno con una réplica para cada complejo, luego se separaron botellas iniciales, botellas claras al 50% y 100% de la intensidad lumínica, seguido de botellas oscuras forradas totalmente para garantizar la evaluación de la respiración (ver Figura 2). Esto se hizo utilizando tubos de acrílico que permitían el ingreso de la luz deseada. Para obtener las diferentes intensidades lumínicas, se cubrieron los tubos de acrílico transparente con filtros de luz, los cuales fueron calibrados utilizando un luxómetro portátil (MINIPAL, MLM1010). La intensidad lumínica de referencia, es decir, el 100%, se obtuvo utilizando un tubo de acrílico sin ningún tipo de filtro. Para medir la respiración, se utilizaron botellas Winkler que se incubaron en tubos de PVC completamente oscuros, asegurando la ausencia de luz. En cada estación, se tomaron tres réplicas por cada intensidad lumínica: tres para las botellas claras en las diferentes intensidades lumínicas, tres para las botellas oscuras y tres para medir el nivel de oxígeno inicial. (ver Figura 2 e Figura 3) Terminada la organización de las botellas se procedió a su incubación durante una hora desde las 11:00 am hasta las 12:00 del mediodía. Terminada la incubación de las botellas, se llevaron a titulación con tiosulfato, reactivos de Winkler y almidón para posteriormente obtener la medida del oxígeno disuelto siguiendo el método de Winkler, con modificaciones (Strickland y Parsons, 1972), a través de la siguiente formula:
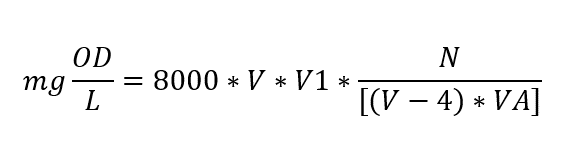
Donde V es el volumen de la botella winkler; V1 el volumen del tiosulfato gastado; VA el volumen de la alícuota; y N la Normalidad del tiosulfato (0.01 N). Para determinar la producción bruta, neta y respiración se utilizaron las siguientes formulas:
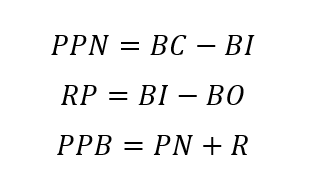
Donde, BI = concentración de oxígeno en la botella inicial, PPN = producción Neta, BC= concentración de oxígeno botella clara, RP= respiración pelágica, BO = concentración de oxígeno botella oscura, PPB = producción bruta.
Análisis estadístico
Se efectuaron representaciones gráficas en tiempo para cada variable por estación, también se evaluaron diferencias entre estaciones mediante la prueba no paramétrica U de Mann-Whitney, después de comprobar mediante Shapiro-Wilk y Levene que los datos no cumplían supuestos de normalidad y homocedasticidad requeridos para un ANOVA, para lo anterior se utilizó el programa de PAST 2.1, mientras que para realizar los gráficos de producción primaría del fitoplancton se utilizó el programa GraphPad Prism 8.0.
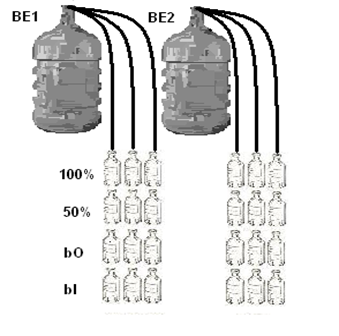
Figura 2. Forma de ordenar y llenar las botellas winkler para el posterior montaje en la plataforma de incubación in situ, botellones de 20 L de agua colectados en cada estación; (100% y 50%) porcentajes de intensidad de luz; (bO) botellas oscuras; (bI) botellas iniciales.
Figura 3. Esquema de la plataforma de incubación con los tubos de acrílico y los de PVC con las botellas claras y oscuras en la Laguna Buena Vista.
RESULTADOS Y DISCUSIÓN
Variables fisicoquímicas
Tabla 1. Variables fisicoquímicas registradas en las estaciones 1 y 2 del área de estudio, en el mes de mayo del año 2016.
|
Variables |
E1 |
E2 |
|
pH |
8,6 |
8,8 |
|
Salinidad |
36,5 |
34,4 |
|
O2 (mg·L-1) |
5,5 |
8 |
|
O2% |
82,1 |
95,4 |
|
Amonio (µg·L-1) |
0,08 |
0,24 |
|
fosfatos (µg·L-1) |
1,61 |
5,12 |
|
Nitratos (µg·L-1) |
0,49 |
1,50 |
|
Nitritos (µg·L-1) |
1,56 |
1,24 |
|
Profundidad (cm) |
37 |
35,5 |
|
Capa fótica (cm) |
16 |
12 |
|
Temperatura (°C) |
26,6 |
26,1 |
Según los resultados obtenidos para el pH, se observó que en la E2 los valores fueron ligeramente más altos, sin embargo, en términos generales esta variable en las dos estaciones fue alta. De acuerdo con los datos de pleamares y bajamares de Riohacha (IDEAM. 2016), durante la primera semana de mayo de 2016, se puede inferir que estos valores altos registrados en las dos estaciones ocurrieron debido a la influencia de las pleamares. Las pleamares que ocurrieron en Riohacha durante esa semana alcanzaron alturas máximas de 0.37m, permitiendo una mayor intrusión de agua de mar en la zona estuarina (IDEAM. 2016). Este aumento en el pH es característico de las zonas estuarinas debido a su cercanía al mar. En las zonas estuarinas, donde se produce la mezcla de agua dulce y agua salada proveniente del mar, se puede esperar un ligero aumento en el pH debido a la presencia de compuestos alcalinos. Diversos estudios han encontrado resultados similares en zonas estuarinas costeras. Por ejemplo, Bociąg et al.(2014) investigaron las características del agua en el estuario del río Vistula y observaron que los valores de pH eran ligeramente más altos en comparación con las áreas de agua dulce, indicando una ligera alcalinidad asociada con la influencia marina. Asimismo, un estudio realizado por Jalali et al. (2016) en el estuario del río Támesis encontró que el pH del agua aumentaba a medida que se avanzaba hacia el área cercana al mar, debido a la influencia salina y la presencia de especies alcalinas. Esto también coincide con los hallazgos de Granados et al.(2011), quienes estudiaron la producción primaria en la CGSM y encontraron que la estación más cercana al mar registró los valores más altos de pH.
Por otro lado, la salinidad generalmente fue alta, registrándose el valor más elevado en la E1. En términos de oxígeno disuelto, se observó un valor más alto en la E2, aunque ambos valores son adecuados para el mantenimiento de organismos acuáticos. El valor de salinidad en ambas estaciones fue alto, posiblemente porque en la época que se realizaron los muestreos existió una mayor influencia de la intrusión de agua marina, especialmente durante los periodos de pleamar. El agua de mar contiene altas concentraciones de sales disueltas, por lo que su ingreso incrementaría los niveles de salinidad (Abd-Elaty et al., 2018). Adicionalmente, la evaporación en esta zona costera podría concentrar aún más las sales, generando los altos valores detectados.
En cuanto al oxígeno, la ligera diferencia entre estaciones podría deberse también a procesos relacionados con la dinámica costera. La acción de las olas y mareas en la desembocadura podría favorecer una mejor oxigenación del agua en E2 al incrementar la turbulencia y el intercambio con la atmósfera. Asimismo, el plancton marino y otra biota ingresada con la marea podrían contribuir a la producción de oxígeno vía fotosíntesis. No obstante, se necesitarían más mediciones para confirmar esta hipótesis sobre las causas de las diferencias en oxígeno disuelto entre puntos.
El oxígeno disuelto es un parámetro crítico para la supervivencia de la vida acuática, ya que los organismos dependen de él para llevar a cabo procesos metabólicos esenciales. Según estudios previos, se considera que los niveles adecuados de oxígeno disuelto para el mantenimiento de la fauna y flora acuática varían según las especies y las condiciones ambientales. Sin embargo, en general, se acepta que los niveles de oxígeno disuelto por encima de 5 mg·L-1 son suficientes para soportar la mayoría de las formas de vida acuática (Chapman, 1996). De igual manera, la saturación de oxígeno mostró un comportamiento similar en ambas estaciones.
En cuanto a los nutrientes, se observó que los niveles de amonio en la E1 fueron casi imperceptibles, mientras que en la estación dos fueron ligeramente más altos, aunque en general se consideran bajos. Los bajos niveles de nutrientes inorgánicos disueltos, especialmente nitratos, hallados en este estudio son consistentes con lo reportado por Rodríguez-Chila et al. (2009) para la Ciénaga Grande de Santa Marta (CGSM) en 2005. Estos autores registraron concentraciones de amonio de 0.1 a 14.2 μg-at·L-1, nitritos entre 0.2 y 3 μg-at·L-1, y nitratos mayormente no detectables, con valores ocasionales de hasta 3 μg-at·L-1. Las bajas concentraciones encontradas en la presente investigación se asemejan a este rango. Rodríguez-Chila et al. (2009) atribuyen los niveles bajos de nitrógeno inorgánico disuelto a la menor influencia de escorrentía continental durante su periodo de muestreo. De manera similar, las concentraciones registradas en este estudio sugieren una limitada descarga fluvial de nutrientes en la época de muestreo. Coincidiendo con esto, Granados et al. (2011) reportaron mayores niveles de amonio, nitritos y fosfatos durante periodos de mayor influencia de agua dulce continental proveniente de los ríos que desembocan en la CGSM. En términos generales, la relación entre nutrientes y parámetros ambientales encontrada se corresponde con condiciones naturales típicas en sistemas estuarinos costeros como éste, fuertemente regulados por la dinámica hídrica continental y marina, tal como describen Granados et al. (2011) para la CGSM.
Los nitratos, nitritos y fosfatos, por otro lado, fueron relativamente altos en ambos puntos de muestreo (tabla 1). Estos niveles elevados de nutrientes podrían explicarse por el hecho de que la laguna actúa como un reservorio, acumulando los nutrientes arrastrados por el río Ranchería. Varios estudios han demostrado que los ecosistemas acuáticos, como las lagunas y los cuerpos de agua costeros, tienen la capacidad de retener y acumular nutrientes provenientes de fuentes terrestres, como los ríos que desembocan en ellos (Boynton et al.,1982; Cloern et al.,2014; Hernández,2017). Esto se debe a procesos como la sedimentación y la interacción entre el agua dulce y el agua salada (Mitsch & Gosselink, 2007). Un ejemplo relevante es el estudio de Granados et al. (2011) en la Ciénaga Grande de Santa Marta, ya que encontraron que las zonas agrícolas cercanas eran responsables de los altos niveles de nutrientes (nitratos, nitritos y fosfatos) en el ecosistema. Estos resultados respaldan la idea de que las actividades agrícolas pueden contribuir a la carga de nutrientes en los cuerpos de agua. Además, otro estudio realizado por Lacerda et al. (2009) examinó la capacidad de los manglares para acumular nutrientes en la zona costera. Encontraron que los manglares pueden actuar como sumideros de nutrientes, capturando y reteniendo nitrógeno y fósforo, lo que puede resultar en niveles altos de nutrientes en los cuerpos de agua adyacentes. Por lo tanto, los niveles elevados de nutrientes observados en ambos puntos de muestreo de la laguna Buenavista podrían ser explicados por la capacidad de la laguna para acumular los nutrientes arrastrados por el río (Molina et al.,2020), fenómeno que ha sido documentado en otros estudios en ecosistemas similares.
En cuanto a la profundidad, la capa fótica y la temperatura, se observó que los valores obtenidos fueron consistentes con otros ecosistemas costeros de este tipo, caracterizados por altas temperaturas, poca profundidad y poca transparencia. Los ecosistemas costeros, como las lagunas y las áreas cercanas al mar, a menudo se caracterizan por tener aguas poco profundas y altas temperaturas debido a la influencia de la radiación solar y la interacción entre el agua y la atmósfera (Hinrichsen, 2000). Varios estudios han documentado estas características en ecosistemas costeros similares. Por ejemplo, Hernández y Gocke (1990) examinaron las características físicas de lagunas costeras y encontraron que la temperatura del agua tiende a ser alta, la profundidad es generalmente baja y la transparencia del agua es reducida debido a la presencia de sedimentos y materia orgánica. Además, un estudio realizado por Gocke et al. (2003) en la CGSM también destacó la poca profundidad y la baja transparencia del agua, así como la alta temperatura en ese ecosistema costero. Asimismo, Hernández-Jiménez (2017) llevó a cabo una investigación en la ciénaga de pajaral y encontró que las características mencionadas, incluyendo altas temperaturas, poca profundidad y poca transparencia, son comunes en estos tipos de ecosistemas. En resumen, los valores de profundidad, zona fótica y temperatura observados en la laguna Buenavista son consistentes con las características típicas de los ecosistemas costeros del Caribe (Hernández y Gocke, 1990; Gocke et al., 2003; Hernández-Jiménez, 2017).
Valores de Producción Primaria del fitoplancton
Los valores promedios de producción primaria neta (PPN) fueron más altos en la E1, con un valor de 2,6 gC·m-2·d-1, mientras que para la E2 fueron de 1,7 gC·m-2·d-1. Los resultados de la prueba U de Mann-Whitney indican que no existen diferencias estadísticamente significativas entre las estaciones E1 y E2 en cuanto a la producción primaria neta (PPN). Los estadísticos U calculados de 3 y 1 fueron menores que los valores U críticos de 0 y 2 respectivamente, con un nivel de significancia del 5% (α=0.05). Los valores de PPN observados en este estudio fueron altos en comparación con los valores correspondientes a otros ecosistemas de gran representación, como en la CGSM, donde se han registrado valores similares. Un estudio realizado por Devercelli et al. (2010) en la CGSM encontró valores de PPN en el rango de 1.2-3.0 gC·m-2·d-1, lo cual es consistente con los resultados obtenidos en la E1. Estos valores altos de PPN pueden estar relacionados con los valores elevados de nutrientes encontrados en la laguna Buenavista. En cuanto a la producción primaria bruta (PPB), el valor también mostró un comportamiento diferente entre estaciones, siendo más alto en la E1 con un valor de 3,4 gC·m-2·d-1, mientras que en la E2 fue de 2,5 gC·m-2·d-1. Al realizar la prueba U de Mann-Whitney se encontraron diferencias estadísticamente significativas entre las estaciones para la PPB (p < 0.05). Esto indica que la PPB presenta diferencias significativas entre E1 y E2. Por otro lado, la respiración mostró un valor similar en ambas estaciones y estuvo por debajo de los valores de PPN.
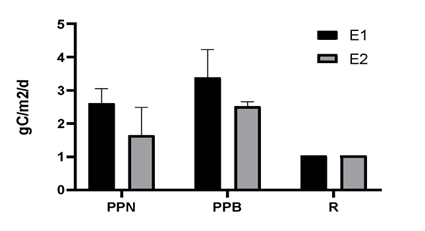
Figura 4. Producción primaria neta (PPN), producción primaria bruta (PPB) y respiración (R), de dos estaciones (E1 y E2) en la Laguna Buena Vista en el mes de mayo del año 2016.
Varios estudios han demostrado que los nutrientes, como los nitratos y fosfatos, pueden estimular la producción primaria en los ecosistemas acuáticos (Boynton et al., 1982; Howarth et al., 2012). Por otro lado, la baja tasa de respiración en comparación con la PPN sugiere que existe un excedente de energía que se exporta a otros ecosistemas. Además, esta energía-materia de subsidio que ingresa al mar Caribe puede fertilizar una amplia región costera, beneficiando la productividad biológica en general. En resumen, los altos valores de PPN observados en la E1 en comparación con la E2, así como la baja tasa de respiración, sugieren una productividad primaria alta y un excedente de energía en la laguna Buenavista. Estos resultados están respaldados por la relación entre la disponibilidad de nutrientes y la producción primaria, así como por los patrones observados en otros ecosistemas similares.
Se puede concluir que el balance metabólico de la laguna Buenavista es autotrófico, ya que la producción primaria neta (PPN) es mayor que la respiración. Esta condición indica un estado ambiental favorable en la laguna. Esta afirmación sugiere que la laguna Buenavista tiene una capacidad para generar más energía a través de la fotosíntesis y la producción de materia orgánica que la cantidad de energía consumida por la respiración de los organismos. Un balance metabólico autotrófico es considerado una señal de un ecosistema saludable y productivo. Varios estudios respaldan esta afirmación. Por ejemplo, Goldman & Horne (1983) examinaron el papel de la producción primaria en el funcionamiento de los ecosistemas acuáticos y destacaron que un balance autotrófico positivo es esencial para mantener una comunidad biológica diversa y productiva. Además, un estudio realizado por Duarte et al. (2005) en ecosistemas marinos costeros encontró que los ecosistemas con un balance autotrófico positivo tienden a ser más resistentes a perturbaciones y tienen una mayor capacidad de recuperación después de eventos estresantes, como contaminación o cambios ambientales. Por otro lado, una revisión de literatura realizada por Hillebrand et al. (2018) examinó múltiples ecosistemas acuáticos y encontró una fuerte correlación entre un balance autotrófico positivo y la biodiversidad, la salud del ecosistema y la eficiencia en el uso de los recursos. Sin embargo, es importante destacar que este análisis se basa en la comparación de la PPN y la respiración específicamente en este estudio.
Finalmente, los resultados muestran altos valores de producción primaria neta (PPN) en la Laguna Buenavista, relacionados con las elevadas concentraciones de nutrientes como nitratos y fosfatos. Esto concuerda con estudios previos que han demostrado cómo los nutrientes estimulan la producción primaria en ecosistemas acuáticos (Boynton et al., 1982; Howarth et al., 2012). En este contexto, es clave discutir el rol de las lagunas costeras como reservorios y fuentes de estos nutrientes. Se ha documentado que estuarios y lagunas como Buenavista reciben aportes continentales ricos en nutrientes, los cuales son retenidos y transformados químicamente en estas cuencas (McLusky & Elliott, 2004). Luego, los nutrientes son exportados hacia aguas costeras adyacentes, fertilizando amplias áreas del océano y promoviendo la productividad de todo el ecosistema costero.
Específicamente, la Laguna Buenavista recibe aguas del río Ranchería que drenan una extensa región, transportando nutrientes de origen natural y antropogénico. El estuario actúa como un eficiente transformador biogeoquímico, reteniendo parte de estos nutrientes y liberando formas disponibles para el fitoplancton como nitratos, nitritos y fosfatos. Esto se ve reflejado en la alta PPN registrada. Por tanto, los resultados de este estudio sugieren que la laguna podría jugar un importante rol ecológico en el incremento de la fertilidad y productividad del ecosistema estuarino. Asimismo, se plantea como hipótesis que la laguna también podría aumentar la productividad de las aguas marinas adyacentes, a través de los aportes de nutrientes y materia orgánica que estas reciben desde el sistema estuarino.
CONCLUSIONES
La Laguna Buenavista presentó características fisicoquímicas típicas de un ecosistema estuarino tropical, incluyendo altas temperaturas, baja transparencia y somera profundidad. Los niveles de nutrientes como nitratos, nitritos y fosfatos fueron elevados, indicando un aporte importante del río Ranchería. Por otro, la laguna actúa como un reservorio y transformador de estos nutrientes, donde la producción primaria neta (PPN) registró valores altos en comparación con otros ecosistemas similares, relacionados con la disponibilidad de nutrientes. No hubo diferencias significativas en PPN entre estaciones, mientras que la producción primaria bruta (PPB) mostró diferencias significativas entre estaciones, siendo mayor en E1. La respiración fue menor que la PPN, sugiriendo un excedente de producción que puede ser exportado a aguas costeras adyacentes, finalmente, el balance metabólico autotrófico y alta PPN, sugieren que la laguna actúa como reservorio y fuente de nutrientes para el ecosistema estuarino. Se plantea la hipótesis de que la laguna también podría incrementar la productividad del ambiente marino adyacente a través de sus aportes.
LITERATURA CITADA
Abd-Elaty, I., Abd-Elhamid, H.F., & Negm, A.M. (2018). Investigation of Saltwater Intrusion in Coastal Aquifers. In A.M. Negm (Ed.), The Handbook of Environmental Chemistry (Vol. 73, pp. 3094). Springer. https://doi.org/10.1007/698_2018_275
APHA, 1998. Standard Methods for examination of water and wastewater. 20th Edition. American Public Health Association, American Water Works Association and Water Environmental Federation.
Barocio, S., Valdez, R., Carmona, M. C., & Navarro, A. (2007). Contribución neta de carbono vía fotosíntesis del fitoplancton en la zona costera adyacente a B.C.S., México. Ciencias Marinas, 33(4), 399-409. https://doi.org/10.7773/cm.v33i4.1355
Bociąg, K., Skwarzec, B., Strączek, M., & Bokuniewicz, H. (2014). Distribution and sources of nutrients in a coastal ecosystem of the Gulf of Gdańsk (southern Baltic Sea). Marine Pollution Bulletin, 83(1), 270-277.
Botero, L. & Mancera, José. (1996). Síntesis de los cambios de origen antrópico ocurridos en los últimos 40 años en la Ciénaga Grande de Santa Marta (Colombia). Rev. Acad. Colomb. Cienc. 20. 465-474.
Boynton, W. R., Kemp, W. M., & Keefe, C. W. (1982). A comparative analysis of nutrients and other factors influencing estuarine phytoplankton production. En Estuarine comparisons (pp. 69-90). Academic Press.
Chapman, D. (1996). Water Quality Assessments: A Guide to the Use of Biota, Sediments and Water in Environmental Monitoring. CRC Press.
Cloern, J. E. (1996). Phytoplankton bloom dynamics in coastal ecosystems: a review with some general lessons from sustained investigation of San Francisco Bay, California. Reviews of Geophysics, 34(2), 127-168.
Cloern, J. E., Foster, S. Q., & Kleckner, A. E. (2014). Phytoplankton primary production in the world's estuarine-coastal ecosystems. Biogeosciences, 11(9), 2477-2501.
Cloern, J. E., Schraga, T. S., Lopez, C. B., Knowles, N., Grover Labiosa, R., & Dugdale, R. (2005). Climate anomalies generate an exceptional dinoflagellate bloom in San Francisco Bay. Geophysical Research Letters, 32(14).
Corpoguajira e Instituto de investigaciones marinas [INVERMAR]. (2012). Atlas marino costero de La Guajira. Serie de Publicaciones Especiales de Invemar No. 27. Santa Marta, Colombia. 188p.
Devercelli, M., O’Farrell, I., y Izaguirre, I. (2010). Phytoplankton classes and primary productivity in a well mixed temperate wetland (Ciénaga Grande de Santa Marta, Colombia). Wetlands Ecology and Management, 18(1), 55-68.
Devercelli, M., Piccolo, M. C., & Perillo, G. M. (2010). Estudio preliminar sobre la producción primaria en la Ciénaga Grande de Santa Marta, Colombia. Revista de Biología Tropical, 58(1), 287-300.
Duarte, C. M., Agustí, S., & Wassmann, P. (2005). Ecological coupling among biotic compartments in marine systems. Ecological Studies (Analysis and Synthesis),189, (7-21).
Eppley, R. W. (1972). Temperature and phytoplankton growth in the sea. Fish. bull, 70(4), 1063-1085.
Gil-Torres W., Fonseca, G., J. Restrepo, P. Figueroa, L. Gutiérrez, G. Gómez, M., Sierra-Correa, P.C., Hernández Ortiz, M., A. López. y C. Segura-Quintero. (2009). Ordenamiento ambiental de los manglares de la alta, media y baja Guajira.
Gocke, K. (1987). Manual para determinar los procesos de producción y degradación en biotopos marinos, especialmente en lagunas costeras y manglares. Mimeógrafo en la biblioteca del Instituto de Investigaciones Marinas y Costeras INVEMAR.
Gocke, K., Mancera Pineda, J. E., Vidal, L. A., & Fonseca, D. (2003). Planktonic primary production and community respiration in several coastal lagoons of the outer Delta of the Río Magdalena, Colombia. Boletín de Investigaciones Marinas y Costeras-INVEMAR, 32(1), 125-144.
Goldman, C. R., & Horne, A. J. (1983). Limnology (2nd ed.). McGraw-Hill.
Granados, M. G., Chila, J. R., & Salgado, H. L. (2011). Producción primaria fitoplantónica y metabolismo durante una época lluviosa en una laguna costera estuarina tropical, Ciénaga Grande de Santa Marta. Intropica, 6, 9-19.
Gutiérrez, D., Dominguez, R., Nunez, J. J., Real, R., & Benayas, J. (2006). Capturing actual distributions of butterfly diversity at the generic level in peninsular Spain: Implications for conservation planning. Biodiversity and Conservation, 15(3), 659-677.
Hernández- Jiménez, C. A. (2017). Efectos de la entrada de agua del río Magdalena en la producción primaria del fitoplancton en la ciénaga Pajaral, Caribe colombiano. Intropica, 12(2). https://doi.org/10.21676/23897864.2315
Hernández, C. A., & Gocke, K. (1990). Productividad primaria en la Ciénaga Grande de Santa Marta, Colombia. Anales del instituto de investigaciones marinos costeras, punta betín, 19-20, 101-119.
Hillebrand, H., Borer, E. T., Bracken, M. E., Cardinale, B. J., Cebrian, J., Cleland, E. E., ... & Fagan, W. F. (2018). Global synthesis of the response of marine and freshwater ecosystems to nutrient enrichment. Global Change Biology, 24(1), 455-464.
Hinrichsen, R. A. (2000). Coastal ecosystems. In E. A. Norse & L. B. Crowder (Eds.), Marine Conservation Biology: The Science of Maintaining the Sea's Biodiversity. Island Press.
Hopkinson, C. S., & Smith, E. M. (2005). Estuarine respiration: an overview of benthic, pelagic, and whole system respiration. En Giorgo, P & Willians, P. Respiration in Aquatic Ecosystems (pp. 122–146). https://doi.org/10.1093/ACPROF:OSO/9780198527084.003.0008
Howarth, R. W., Marino, R., & Lane, J. (2012). Nitrogen as the limiting nutrient for eutrophication in coastal marine ecosystems: Evolving views over three decades. Limnology and Oceanography, 51(1), 364-376.
IDEAM (2016), Pronóstico de pleamares y bajamares en la costa caribe colombiana. IDEAM. .
Jalali, M. A., Darvishsefat, A. A., Nikouyan, A., Karbassi, A. R., & Baalousha, M. (2016). Spatial and temporal variability of physicochemical parameters in the northern part of the Persian Gulf: a case study of Bushehr. Environmental Earth Sciences, 75(3), 1-13.
Knoppers, B. (1994). Aquatic primary production in coastal lagoons. Elsevier oceanography series (Vol. 60). Elsevier.
Lacerda, L. D., Valiela, I., & Emmett, R. L. (2009). Consequences of human modification of mangrove ecosystems. Coastal Systems .Encyclopedia of Life Support Systems, 12, 132-161.
McLusky, D.S. y Elliott, M. (2004). The Estuarine Ecosystem: ecology, threats and management. Oxford University Press.
Mitsch, W. J., & Gosselink, J. G. (2007). Wetlands (4th ed.). John Wiley & Sons.
Molina Bolívar, G., Nava Ferrer, M. L., & Jiménez Pitre, I. A. (2020). Variables fisicoquímicas del agua en el Delta del Río Ranchería, La Guajira, Colombia. Ciencia en Desarrollo, 11(1), 21-32.
Navas-Parejo, J. C. C., Corzo, A., & Papaspyrou, S. (2020). Seasonal cycles of phytoplankton biomass and primary production in a tropical temporarily open-closed estuarine lagoon—The effect of an extreme climatic event. Science of the Total Environment, 723, 138014.
Odum, E. 1972. Ecología. Editorial Interamericana S.A.
Ramírez, J. Alcaráz, H. (2002). “Dinámica de la producción primaria fitoplanctónica en un sistema eutrófico tropical: Laguna del Parque Norte, Medellín, Colombia”. Caldasia,24,411-423.
Rangel Buitrago, N., & Anfuso Melfi, G. (2012). Morfología, morfodinámica y evolución reciente en la Península de la Guajira, Caribe colombiano.
Riccerca E Copperazzione. (2002). Plan de uso y manejo de los humedales y lagunas costeras de La Guajira. Proyecto prolagunas protección y recuperación de humedales costeros del Caribe colombiano. Informe Final Riccerca-Corpoguajira. 123p.
Rodríguez-Chila, J. D., Mancera-Pineda, J. E., & López-Salgado, H. J. (2009). Efectos de la recomunicación del Río Magdalena con su antiguo delta: cambios en la producción primaria fitoplanctónica y respiración en el complejo Pajarales, 1989 A 2005. Boletín de Investigaciones Marinas y Costeras-INVEMAR, 38(2), 119-144.
Roldán, G., & Ramirez, J. (2008). Fundamentos de limnología neotropical. 2a ed. Universidad de Antioquia.
Rozo, A. M. Monitoreo de aves migratorias y residentes en siete humedales de La Guajira. (2006). Corporación autónoma de La Guajira.
Sánchez, René & Zea, Sven. (2000). Metabolismo de nitrógeno y fósforo inorgánicos disueltos en la columna de agua en una laguna costera tropical (Caribe colombiano). Caribbean Journal of Science. 36, 127-140.
Smith, S. V., & Hollibaugh, J. T. (1997). Annual cycle and interannual variability of ecosystem metabolism in a temperate climate embayment. Ecological monographs, 67(4), 509-533.
Soria-Píriz, S., García-Robledo, E., Papaspyrou, S., Aguilar, V., Seguro, I., Acuña, J., Morales, Á. y Corzo, A. (2017), Size fractionated phytoplancton biomass and net metabolism along a tropical estuarine gradient. Limnol. Oceanogr., 62, S309-S326. https://doi.org/10.1002/lno.10562
Strickland, J. y T. Parsons. (1972). A practical handbook of sea water analysis. Fisheries. Research. Board of Canada.
Vanegas Chamorro, M., Villicaña Ortíz, E., & Arrieta Viana, L. (2015). Cuantificación y caracterización de la radiación solar en el departamento de La Guajira-Colombia mediante el cálculo de transmisibilidad atmosférica. Prospectiva, 13(2), 54-63.
Vollenweider, R. A., Talling, J. F., & Westlake, D. F. (1974). A manual on methods for measuring primary production in aquatic environments. Blackwell Scientific.
Wetzel, R. G. & Likens, G. E. (1991). Limnological Analyses. 2nd ed.: W. B. Springer-Verlag.
BIODATA
Keila Herrera Barliza: Estudiante de la Universidad de La Guajira, Grupo de investigación EBET, Colombia. https://orcid.org/0009-0007-2841-5661. kkarinaherrera@uniguajira.edu.co
Cristian Granados-Martínez: Magister. Docente investigador de la Facultad de Ciencias Básica de la Universidad de La Guajira. Grupo de investigación EBET, Colombia: Doctorando en Ciencias Naturales para el Desarrollo (DOCINADE), Instituto Tecnológico de Costa Rica, Universidad Nacional, Universidad Estatal a Distancia, Costa Rica. https://orcid.org/0000-0003-0161-9537. Publicaciones recientes: (2023). Primer registro del género Chloronia Banks, 1908 (Megaloptera: Corydalidae) para la Sierra Nevada de Santa Marta, Colombia. Boletín Científico Centro de Museos Museo de Historia Natural (10.17151/bccm.2023.27.1.11). (2021). Zunielmis pax, a new genus and species of riffle beetles (Coleoptera: Elmidae) from Colombia. Zoosystematica Rossica (10.31610/zsr/2021.30.2.248).
Bienvenido Bastidas Molina: Biólogo. Docente de la Universidad de La Guajira, Riohacha, Colombia. Grupo de investigación Ecología, Biodiversidad de Ecosistemas Tropicales, EBET. Colombia. https://orcid.org/0000-0002-8844-8824